宮浦硼酸化反應
宮浦硼酸化反應(Miyaura Boration)
國立臺灣師範大學化學系碩士生 趙姿晴
宮浦憲夫 (Norio Miyaura)1,1946 年出生於日本北海道,並在 1976 年於北海道大學完成他的工學博士學位,之後他在 Akira Suzuki 團隊擔任研究助理和助理教授,直到 1994 年 Suzuki 教授退休後,他晉升為教授,最後於 2010 年退休並榮獲榮譽退休教授。
1979 年鈴木章 (Akira Suzuki) 發表的鈴木—宮浦耦合反應(Suzuki-Miyaura coupling,式一)獲得 2010 年諾貝爾化學獎,是一個較新的有機偶聯反應,是在鈀配合物催化下,芳香基或烯基的硼酸或硼酸酯與氯、溴、碘代芳香烴或烯烴發生交叉偶聯。
1981 年,他加入印第安納大學 J. K. Kochi 教授的團隊擔任博士後研究員,研究方向為利用 salen-oxometal complexes 催化進行烯類的環氧化反應,而他目前感興趣的領域是利用金屬催化合成有機硼化合物2。
許多有機金屬和非金屬試劑現在可用於類似的金屬催化的反應,但近來在實驗室和工業上大部分的焦點集中於使用的有機硼酸,它是一個很方便的試劑,通常具有熱穩定性,且很容易去除反應中的無機副產物,所以適用於工業製成的反應。
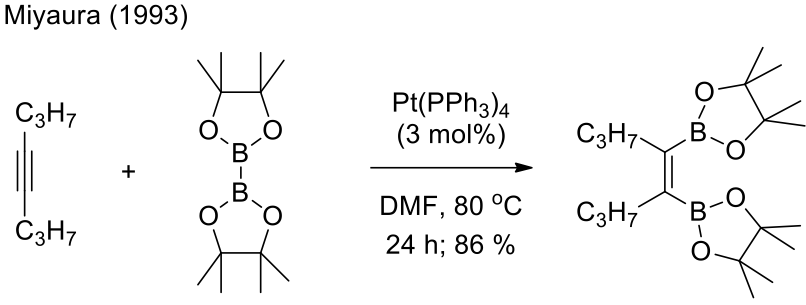
宮浦於 1993 年發現可以利用炔類和雙聯【酉品】醇硼酸酯 (Bis (pinacolato) diboron, $$\mathrm{B_2pin_2}$$) 在四(三苯基磷)鉑 (Tetrakis (triphenylphosphine) platinum (0), $$\mathrm{Pt(PPh_3)_4}$$) 催化下可以合成順式的雙硼化合物3,如圖二所示。
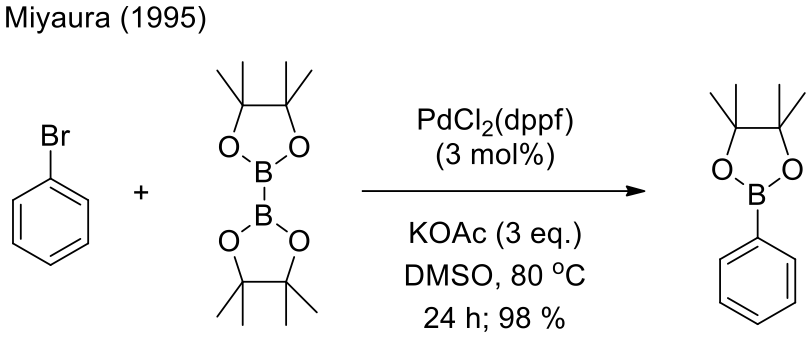
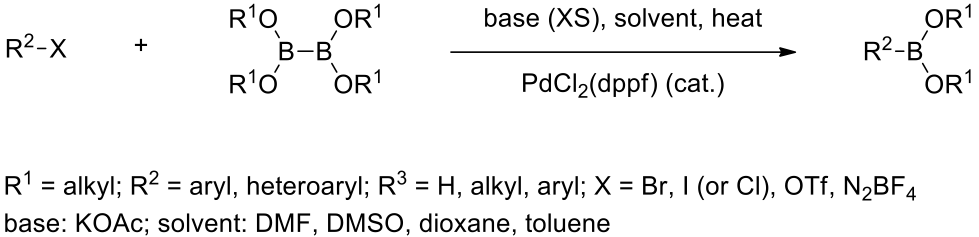
並於 1995 年發現四烷基硼化合物可以利用催化量(1,1′-雙(二苯基膦)二茂鐵)二氯化鈀 ([1,1’-Bis (diphenylphosphino) ferrocene] dichloropalladium (II), PdCl2 (dppf)) 結合的芳香族鹵化物,得到芳香基硼酸酯,如圖三所示;其產物在鈴木偶聯反應 (Suzuki cross-coupling) 和 Ullmann biaryl ether 合成中是重要起始物4。在鈀催化下,四烷基硼化合物和芳香族或雜環芳香族鹵化物的交叉偶聯反應後,得到的芳香基硼酸酯或雜環硼酸酯,而此反應就被稱為宮浦硼酸化反應,其反應條件如圖四所示。
這個反應有幾個特點,(1) 是屬於一鍋化反應且反應很溫和改善了傳統合成芳香基硼酸酯的方法,很多官能基也可以在溫和的鹼下進行反應;(2) 最好的反應物是芳香溴化物或碘化物,而芳香族上的取代基常是推電子基團或拉電子基團;(3) 多電子的芳香溴化物的反應較芳香碘化物慢;(4) 乙酸鉀 (KOAc) 在這個反應之中是很重要的,是使芳香鹵化物能成功被偶聯的關鍵,且除此之外他不但可以使反應加速進行,也可以避免進行鈴木偶聯反應使副產物的生成。5
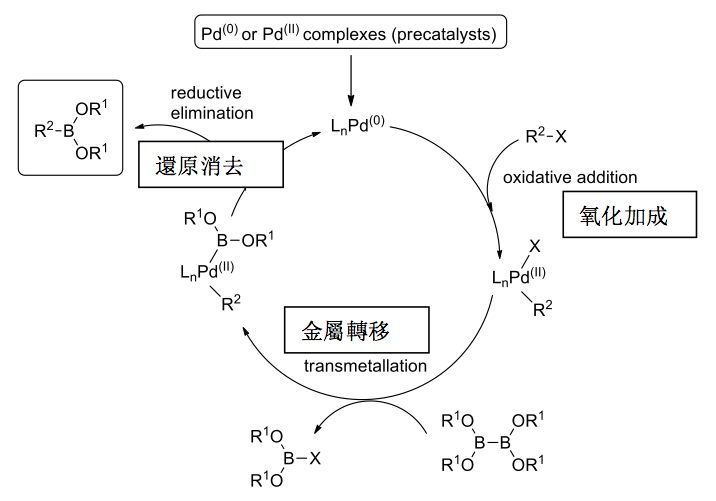
圖五為宮浦硼酸化反應機制:第一步Pd(0)和芳香鹵化物先進行氧化加成,接著當金屬轉移發生時,機制取決於反應物,最後再進行還原消除反應,得到最終產物。
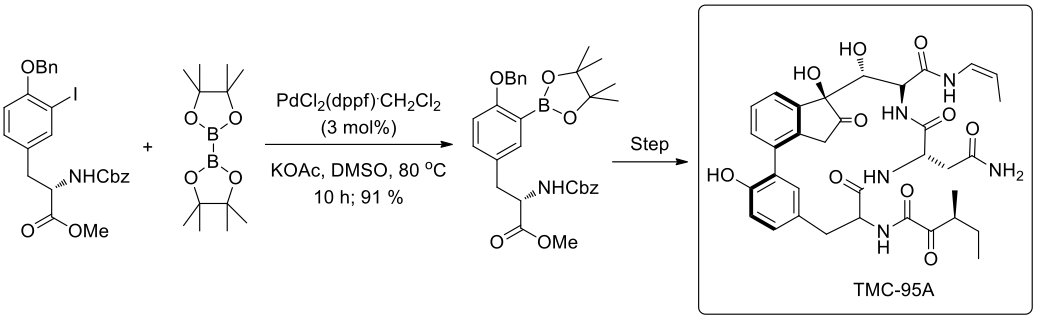
S.J. Danishefsky 和他的同事利用全合成方法蛋白酶抑制環肽 TMC-95A,反應式見圖六。聯芳香基在天然物由鈴木偶聯反應得到,透過芳香基碘化物和L-酪氨酸衍生的芳香基硼酸酯的反應所構成,而所需的芳香基硼酸【酉品】醇反應物是應用宮浦硼酸化反應來製備的,利用此方法偶合的過程之中可以得到較高的產率且沒有鏡像的聯芳香基副產物產生。6
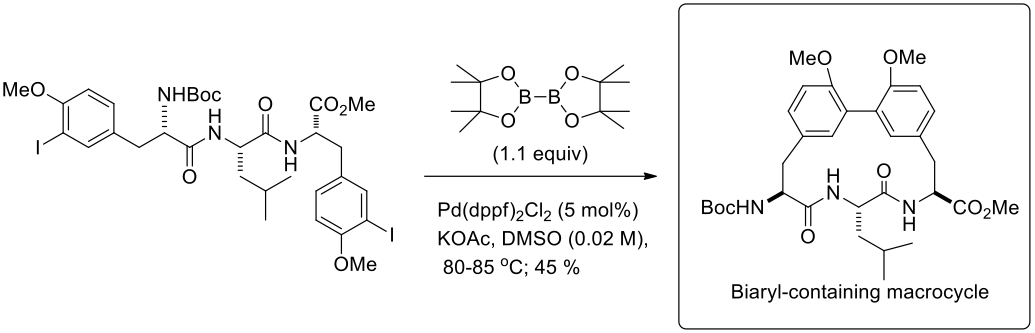
J. Zhu 實驗室發展出一種新穎的方法環化反應合出具有聯芳香基且較大的環,利用連鎖反應–宮浦硼酸化/鈴木分子內交叉偶合,而成功的合出較大的環,並已經確定該濃度和鹼的性質是兩個重要的因素,如圖七所示。7
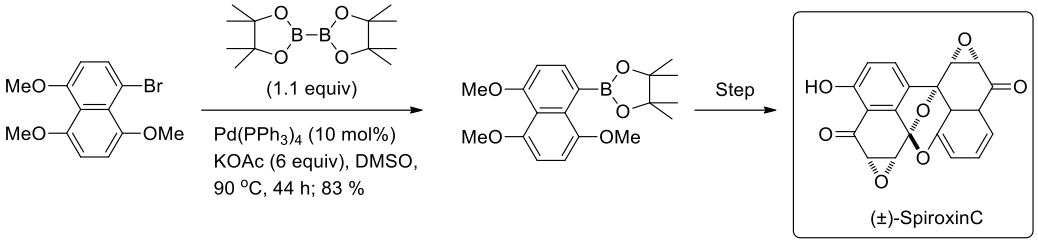
T. Imanishi 團隊等人利用全合成出強效抗菌的海洋天然物(±)-spiroxin C(圖八),是利用四正丁基氟化銨活化鈴木交叉偶合反應的關鍵步驟,以形成聯芳香基,他的合作夥伴使用萘硼酸酯當作宮浦硼酸化的準備。8
參考文獻
- Prof.Norio Miyaura — CSJ Award 2007. http://www.csj.jp/csj-en/membership/awards/achieve/2007-miyaura.html
- Miyaura, N., & Suzuki, A. (1995). Palladium-catalyzed cross-coupling reactions of organoboron compounds. Chemical reviews, 95(7), 2457-2483.
- Ishiyama, T., Matsuda, N., Miyaura, N., & Suzuki, A. (1993). Platinum (0)-catalyzed diboration of alkynes. Journal of the American Chemical Society, 115(23), 11018-11019.
- Ishiyama, T., Murata, M., & Miyaura, N. (1995). Palladium (0)-catalyzed cross-coupling reaction of alkoxydiboron with haloarenes: a direct procedure for arylboronic esters. The Journal of Organic Chemistry, 60(23), 7508-7510.
- Kurti, L., & Czakó, B. (2005). Strategic applications of named reactions in organic synthesis. Elsevier. pp.296-297.
- Lin, S., & Danishefsky, S. J. (2002). The Total Synthesis of Proteasome Inhibitors TMC‐95A and TMC‐95B: Discovery of a New Method To Generate cis‐Propenyl Amides. Angewandte Chemie, 114(3), 530-533.
- Carbonnelle, A. C., & Zhu, J. (2000). A novel synthesis of biaryl-containing macrocycles by a domino miyaura arylboronate formation: intramolecular suzuki reaction. Organic letters, 2(22), 3477-3480.
- Miyashita, K., Sakai, T., & Imanishi, T. (2003). Total synthesis of (±)-spiroxin C. Organic letters, 5(15), 2683-2686.



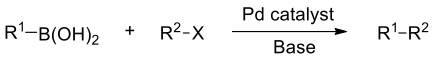
 前一篇文章
前一篇文章 下一篇文章
下一篇文章
