呋喃(Furan)
呋喃(Furan)
國立新莊高級中學化學科陳偉民退休教師/國立台灣師範大學化學系葉名倉教授責任編輯
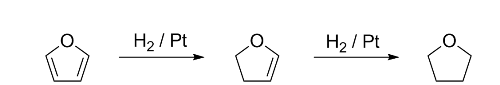
呋喃是一種雜環有機化合物。通常由含纖維素固體如松木,或含五碳醣的物質經由熱分解製取。呋喃為無色、可燃,具高度揮發性的液體,其沸點31.3 ℃,接近室溫,有毒且可能有致癌性。呋喃經由鈀催化,可氫化產生四氫呋喃,為主要的有機溶劑。
歷史
呋喃命名的由來是源自拉丁字furfur,意思是糠。在1780年謝累(Carl Wilhelm Scheele)第一個製成呋喃的衍生物──2-糠酸(2-furoic acid)。另一種重要的呋喃衍生物糠醛(furfural)則是在1831年由德培萊納(Johann Wolfgang Döbereiner)首次製取成功,九年之後由斯登豪斯(John Stenhouse)確認其性質。呋喃本身到了1870年才由林普利特(Heinrich Limpricht)製備成功,不過他稱之為「四酚」。
合成與分離
‧王米桿與硫酸混合後,經熱裂解製得糠醛,糠醛經由氧化與去羧基可製得呋喃。
‧典型的呋喃有機合成法是菲思特-比奈瑞合成法(Feist-Benary synthesis), 此法是利用α-鹵酮與β-雙羰化合物之間的有機反應,生成呋喃的衍生物。
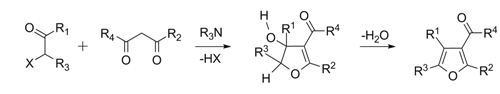
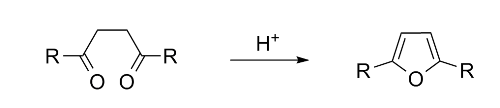
‧合成呋喃最簡單的方法是巴-諾合成法(Paal-Knorr Synthesis),此法是由1,4-二酮與五氧化二磷(P2O5)發生反應。五氧化二磷有同質多晶現象(polymorphism),其中最普遍的一種晶形為十氧化四磷(P4O10)。有趣的是以1,4-二酮與勞森試劑(Lawesson’s reagent )發生反應製取噻吩(thiophene)時,呋喃為其副產品。
化學
因為氧原子上有一孤電子對參與環上的非定域電子雲,與苯一樣符合4n+2芳香族系統(參看休克爾法則),因此呋喃屬芳香族。既然屬於芳香族,呋喃是平面分子且沒有獨立的雙鍵。氧原子上的另一孤電子對由環上系統上的平面向外延伸,sp2混合軌域允許氧原子的一孤電子對留在p軌域,因此可在π系統內交互作用。因為呋喃屬芳香族,其性質與典型的雜環醚如四氫呋喃非常不同。
‧因為雜環上的氧原子供應電子的效應,呋喃在親電子取代反應中,其活性比苯的活性大很多。因共振增加了環上的電子密度,導致親電子取代的反應速率增加。
‧ 在狄-阿反應(Diels-Alder reactions)中,呋喃作為二烯,與缺電子的親二烯物(dienophile)如反3-硝基丙烯酸乙酯發生反應,產物為混合物。
‧ 在呋喃的氫化反應中,可產生二氫呋喃,再進一步產生四氫呋喃。


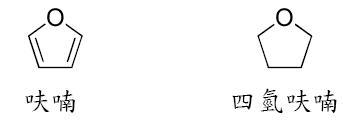
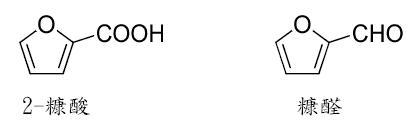
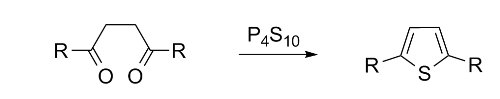

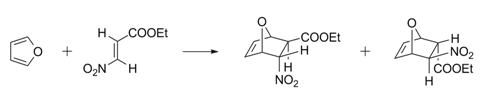
 前一篇文章
前一篇文章 下一篇文章
下一篇文章
