化學實驗室實驗:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔I〕
化學實驗室實驗:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔I〕
國立豐原高級中學化學科蔡亞柏老師/國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之一(Student Handout I)
實驗介紹
本實驗採用簡易型酸鹼度計、PE滴管、10.00 mL的量筒、已標定的NaOH標準溶液及自製小型電磁攪拌器(圖一的左圖和右圖),作為酸鹼滴定的裝置。並且透過兩點電位法酸鹼滴定,來測定食用醋中醋酸的濃度。
使用NaOH標準溶液測定食用醋中醋酸的濃度,是屬於酸鹼滴定中-強鹼滴定弱酸-的類型,當量點pH > 7。傳統上,採用酸鹼指示劑判定滴定終點。本實驗採用兩點電位法來判定滴定終點,與指示劑法不同。兩點電位法是在滴定接近當量點前,記錄兩組滴定體積和pH值的數據(V1,pH1 和V2,pH2 ),透過下面推導的最後式子[式9],計算出在當量點所需要的NaOH標準溶液的真正體積,並藉由化學計量計算出食用醋中乙酸的濃度。
本實驗以NaOH標準溶液測定食用醋中醋酸的濃度為例,說明兩點電位法在當量點時推導所需NaOH標準溶液的體積之過程。在此,假設醋酸(CH3COOH)的初濃度為C0,待測液體積為V0 ;而且假設NaOH標準溶液的初濃度為C。在當量點時,所消耗NaOH標準溶液的體積設為Ve,依酸鹼中和公式,酸和鹼的莫耳數相等,可得[式1]:
C0×V0 = C×Ve [式1]
在當量點前,加入NaOH標準溶液的體積設為V,此時溶液形成CH3COOH-CH3COONa的緩衝溶液。為了計算在當量點前緩衝溶液各物種的pH值,進而推導在當量點時所需要NaOH標準溶液的體積。首先,知道在當量點前緩衝溶液各物種的莫耳數。
CH3COOH + NaOH → CH3COONa + H2O
起始時CH3COOH莫耳數 C0×V0
當量前使用NaOH莫耳數 C×V
當量前CH3COOH莫耳數 (C0×V0) – (C×V)
當量前CH3COONa莫耳數 C×V
然後,確定在當量點前緩衝溶液CH3COOH和CH3COONa的濃度,分別如[式2]和[式3]所示。
接下來,計算緩衝溶液的pH值,如下所述。先利用緩衝溶液的Henderson–Hasselbalch equation,如[式4]所示。再代入[式2]和[式3]到[式4],求得此時溶液的pH值,如[式5]所示。
![]()
![]() 在接近當量點前,記錄兩組滴定體積和pH值的數據(V1,pH1 和V2,pH2 ),代入[式5]中,分別得下列[式6]及[式7]:
在接近當量點前,記錄兩組滴定體積和pH值的數據(V1,pH1 和V2,pH2 ),代入[式5]中,分別得下列[式6]及[式7]:
![]() 最後,整理[式8],可得在當量點時所需要NaOH標準溶液的體積(Ve),得到[式9]。
最後,整理[式8],可得在當量點時所需要NaOH標準溶液的體積(Ve),得到[式9]。
A. 使用器材
1. 電腦散熱風扇 1個/組
2. LM317(三端子可調整穩壓IC) 1個/組
3. 220歐姆電阻 1個/組
4. 1000歐姆可變電阻 1個/組
5. 9伏特電池盒(附開關,含9V乾電池) 1套/組
6. 快乾膠 2條/班
7. 小型麵包板 1個 /組
8. 跳線 數條/組
9. 小磁鐵 2枚/組
10. 扁平紙盒或塑膠盒(如1號濾紙空盒) 1個/組
11. 塑膠容器(小型) 1個/組
12. 小磁石 1個/組
B. 組裝過程
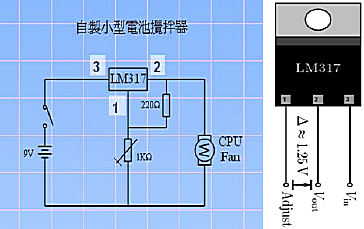
1. 依照圖二的線路圖,佈線相關電子零件於麵包板上,完成電磁攪拌器的控制電路。
2. 以快乾膠對稱黏貼兩塊小磁鐵在電腦散熱風扇的背面上。黏貼時,一塊小磁鐵的S極朝上與另一塊N極對稱朝上放置,如圖三所示。
3. 在扁平紙盒或塑膠盒(如1號濾紙空盒)的一邊割出一個小洞以導出電線,再黏貼散熱風扇組在扁平盒內。連接散熱風扇電源排線至電磁攪拌器的控制電路上,並且連接控制電路到一個9伏特電池盒(附開關,含9V乾電池),形成一個自製小型電磁攪拌器,如圖四所示。
C. 操作說明
1. 放置一個小磁石到一個含有待測液的塑膠容器中,並放置於自製小型電磁攪拌器的正上方,如圖五所示。
2. 調整控制電路中的可變電阻,以調整適當的攪拌速率,如圖六所示。
3. 準備一支PE滴管、一支10.00 mL的量筒、待測液的塑膠容器及自製小型電磁攪拌器,完成滴定實驗的準備工作,如圖七所示。








 前一篇文章
前一篇文章 下一篇文章
下一篇文章
