化學實驗室實驗:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔II〕
化學實驗室實驗:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔II〕
國立豐原高級中學化學科蔡亞柏老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
連結:簡易的滴定終點判定-兩點電位法(Two-point Potentiometric Titration)〔I〕
學生講義之二(Student Handout II)
藥品和器材
1. 自製小型電磁攪拌器 1套/組
2. 簡易型酸鹼度計(如泰菱電子儀器,型號pH-704) 1支/組
3. 標準緩衝溶液(pH 7和pH 4) 1瓶/組
4. 蒸餾水(裝在洗瓶內) 1瓶/組
5. 濾紙(或無毛屑面紙1包) 1盒/班
6. NaOH標準溶液(0.1 M已標定) 30~50 mL/組
7. 量筒(瘦長型,容量10.00 mL,精確度0.01 mL) 2個/組
8. 容量瓶(100 mL) 1個/組
9. 塑膠容器(小型) 1個/組
10. 燒杯(100 mL) 2個/組
11. 食用醋 5 mL/組
12. PE滴管 2支/組
實驗步驟
A.簡易型酸鹼度計的校正
本次實驗採用泰菱電子儀器型號pH-704的簡易型酸鹼度計,其校正步驟如下所示。一般而言,酸鹼度計的校正步驟:(1)先用pH 7.00標準緩衝溶液,(2)再用pH 4.00或pH 10.00標準緩衝溶液。
1. 開啟電源並打開電極保護蓋,以蒸餾水清洗電極並用濾紙或面紙吸乾。
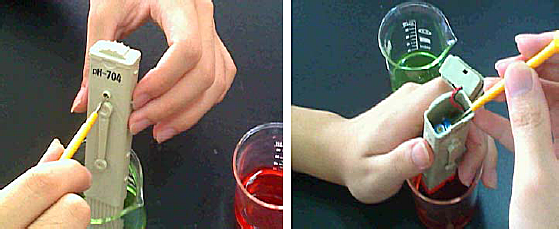
2. 置入電極於pH 7.00標準緩衝溶液中,搖晃後讓顯示值穩定,再用小螺絲起子在酸鹼度計的背面調整顯示值為7.00,如圖八的左圖所示。
3. 顯示值7.00穩定後,即完成此點的校正。取出電極,用蒸餾水清洗電極並用濾紙或面紙吸乾。
4. 然後,置入電極到pH 4.00標準溶液中,搖晃後讓顯示值穩定,再用小螺絲起子在電池蓋內調整顯示值為4.00,如圖八的右圖所示。
5. 顯示值7.00穩定後,即完成此點的校正。取出電極,用蒸餾水清洗電極並用濾紙或面紙吸乾。
6. 重複步驟2~5,使酸鹼度計的測量斜率穩定。
7. 測量待測液:先用洗瓶內蒸餾水清洗電極,再用濾紙或面紙吸乾,插入電極到待測溶液中,均勻地搖晃,讀取酸鹼度計的pH值。
B.估計滴定終點前pH的範圍
已知乙酸(醋酸)的Ka = 1.8 × 10-5,即pKa = 4.74。利用[式5],估計在滴定終點前pH的範圍。
![]() 1. 在滴定終點前,當NaOH標準溶液使用體積為0.96倍的當量點體積(即V = 0.96 Ve)時,代入[式5],得pH = 6.12,計算過程如下所示。
1. 在滴定終點前,當NaOH標準溶液使用體積為0.96倍的當量點體積(即V = 0.96 Ve)時,代入[式5],得pH = 6.12,計算過程如下所示。
![]() 2. 在滴定終點前,當NaOH標準溶液使用體積為0.98倍的當量點體積(V = 0.98 Ve)時,代入[式5],得pH = 6.43,計算過程如下所示。
2. 在滴定終點前,當NaOH標準溶液使用體積為0.98倍的當量點體積(V = 0.98 Ve)時,代入[式5],得pH = 6.43,計算過程如下所示。
1. 用一支PE滴管吸取食用醋,置入一支10 mL的量筒中,量取體積5.00 mL的食用醋。
2. 完全轉移5.00 mL的食用醋到一支100 mL的容量瓶中,加蒸餾水到100.00 mL的刻度線,此稀釋溶液為原來食用醋濃度的1/20倍。每次滴定取20.00 mL的待測液,可用於五次滴定。
D.兩點法的滴定
1. 用一支10.00 mL的量筒,以兩次量取方式共取20.00 mL的食用醋稀釋溶液到一個小型塑膠容器中,插入已校正的酸鹼度計於待測溶液中。
2. 接著使用PE滴定管吸取NaOH標準溶液到10.00 mL的量筒中,讀取量筒的起始刻度(Vi)並記錄之。
3. 開始使用一支PE滴管自上述的量筒中吸取NaOH標準溶液,逐滴地滴入待測溶液中,進行本實驗的酸鹼滴定,並同時注意酸鹼度計的pH讀數與變化,如圖九所示。
4. 經由上面「B. 估計滴定終點前pH的範圍」,可考慮在滴定終點前,當pH值的讀數在6.0時,便可以讀取量筒的刻度(Vf)並記錄第一組滴定數據(V1,pH1)。接著,再滴入少量的NaOH標準溶液,當pH值的讀數比第一組滴定pH1值的讀數大於0.3 pH值,便可以讀取量筒的刻度(Vf)並記錄第二組滴定數據(V2,pH2)。記錄這些滴定的數據於下面「數據記錄與處理」的表一中。
5. 重覆上述步驟1~4兩次,共滴定三次,記錄滴定的數據於表一中。
6. 利用在當量點時酸和鹼的莫耳數相等,計算食用醋中醋酸的濃度(g/mL)。
安全和注意
● 進行實驗操作時,應該注意安全,穿實驗衣和戴安全眼鏡。若不慎接觸NaOH溶液,應該用大量水沖洗,必要時報告老師。
● 若對實驗有安全疑慮以及對酸鹼度計的使用有任何質疑,請立刻詢問老師。
廢棄物處理
● 各組實驗未用的NaOH溶液應該用稀鹽酸中和後排放於水槽中。
● 各組實驗未用的食用醋稀釋溶液可加水稀釋後排放於水槽中。
● 滴定後的混合溶液可加水稀釋後排放於水槽中。
數據記錄與處理
1. 記錄NaOH標準溶液的真正濃度和待測食用醋的基本資料。
NaOH標準溶液的真正濃度: M;
待測食用醋的廠牌和行號: ;
待測食用醋所標示的濃度: %。
2. 記錄兩點法的實驗數據並數據處理於表一。
表一 兩點法的原始數據及當量點的體積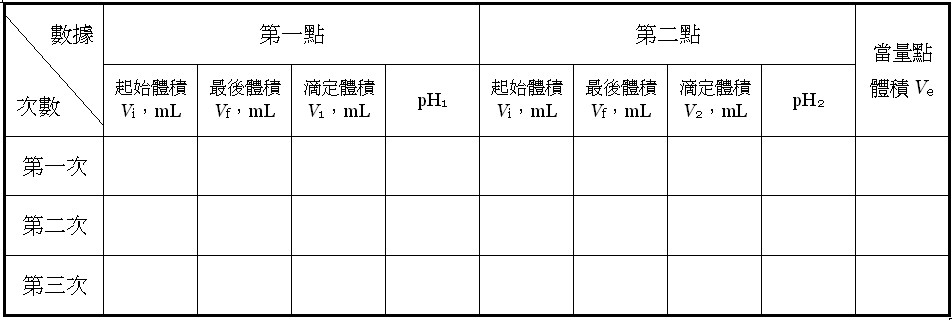 其中NaOH溶液滴定到當量點體積之Ve值是利用[式9]計算而得,△pH = pH2 – pH1。
其中NaOH溶液滴定到當量點體積之Ve值是利用[式9]計算而得,△pH = pH2 – pH1。
![]() 3. 計算三次在當量點時使用NaOH標準溶液體積的平均值 。
3. 計算三次在當量點時使用NaOH標準溶液體積的平均值 。
4. 利用在當量點時酸和鹼的莫耳數相等,計算食用醋中醋酸的濃度(g/mL)。
5. 假設食用醋的密度為1.00 g/ml,此食用醋中醋酸的濃度為多少重量百分比?與廠商標示食用醋的濃度符合嗎?
問題
1. 食用醋為何要先稀釋後才進行酸鹼滴定?
2. 若使用未經標定NaOH溶液時,是否可正確計算出食用醋中醋的酸濃度?為什麼?
3. 相對於使用酚酞為酸鹼指示劑,本次實驗採用兩點法有何優點?說明其理由。



 前一篇文章
前一篇文章 下一篇文章
下一篇文章
