五羰鐵(Iron Carbonyl)
五羰鐵(Iron Carbonyl)
國立臺灣師範大學化學系梁家榮博士班二年級
鐵在人體組織器官內的含量相當高,也是人體必需的微量元素之一。在血液中輸送交換氧氣、氧化還原、呼吸傳遞鏈等生物反應中,都扮演著非常重要的角色。以血紅蛋白(hemoglobin)為例,六配位數的亞鐵離子分別與珠蛋白(globin)和紫質(prophyrin)上的四個氮原子配位。其餘一個配位基則是可以提供血紅蛋載氧時,由氧分子取代水的位置,讓血紅蛋白進行可逆反應以輸送氧氣。但是血紅蛋白對於一氧化碳的親和力遠大於對氧氣的親和力,因此形成一氧化碳血紅素之後,幾乎是不可逆的反應,成為了導致一氧化碳中毒的主因。
一氧化碳分子由其碳原子上的孤對電子,對過渡金屬原子的空軌域產生一個σ 鍵的鍵結,形成一個羰基錯合物。當金屬的電子密度因為羰基的配位而增加時,電子會再從金屬的d軌域去進行反饋鍵合(backbonding)回到羰基上,這個現象會使得過渡金屬的羰基錯合物可以更穩定存在。常見的金屬羰基錯合物有 Fe(CO)5、Cr(CO)6、Ni(CO)4。這類錯合物的中心金屬都是零價的氧化態,化合物帶有18個價電子,符合18價電子規則(18-valence electron rule)。其中,雙三角錐狀的五羰鐵 (iron carbonyl, Fe(CO)5)在有機合成反應中,也是常應用的一種試劑。其製備方式是將未被氧化的精緻化學品鐵粉,在200 °C下通入高壓200 atm的一氧化碳,可以高產率的合成出五羰鐵產物。其熔點為零下 21至零下 22 °C,沸點為103 °C的一種褐色、易揮發、易燃的有毒液體。可溶於低極性的有機溶劑中,不易溶於水,常用來做脫去鹵素的試劑和羰基化試劑。在照光條件下會分解產生一氧化碳,因此具有高毒性。以汞燈照射五羰鐵與醋酸混合之溶液,會脫去一氧化碳而產生金黃色的固體片晶九羰基二鐵(diiron nonacarbonyl, Fe2(CO)9)。(如圖一)2
在溶劑為具有氧原子的溶劑,可以提供配位時使九羰基二鐵產生解離,如乙醚(diethyl ether)、四氫呋喃(tetrahydrofuran)或1,4-二噁烷(1,4-dioxane)等溶劑都可以用來反應產生羰基鐵錯合物3。
$$\mathrm{Fe_2(CO)_9+THF\rightarrow Fe(CO)_5+Fe(CO)_4(THF)}$$
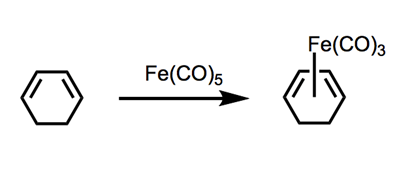
九羰基二鐵與五羰鐵可以產生相似的有機化學反應,但是九羰基二鐵在常溫壓下為固體不具揮發性,但是相較於五羰鐵的使用操作上更為簡便。反應所需之溫度相較於五羰鐵更低,也可降低其反應之危險性。九羰基二鐵或五羰鐵與順式的共軛雙烯(s-cis conjugated diene)反應時,可以脫去兩分子的一氧化碳,改以雙鍵配位在鐵上,生成三羰基共軛雙烯錯合物(tricarbonyl(1,3-diene)iron)4。 (如圖二)
由於順式之共軛雙烯化合物較不穩定,以此合成方式可以固定其順式構型。不易轉變成較為熱力學穩定的反式異構物,可以當作一種順式共軛雙烯的保護基。欲脫去三羰基鐵得到原順式共軛雙烯化合物之方式亦相當簡便,以四價的硝酸鈰銨(ceric ammonium nitrate, CAN)透過電子轉移還原成三價鈰,可以將三羰基鐵氧化後脫去,重新得到原本的雙烯化合物。因此五羰鐵在有機合成上,可以廣泛的被應用在順式共軛雙烯的合成反應。
參考資料:
[1] 五羰鐵 http://en.wikipedia.org/wiki/Iron_pentacarbonyl
[2] 九羰基二鐵 http://en.wikipedia.org/wiki/Diiron_nonacarbonyl
[3] Cotton, F. A.; Troup, J. M. J. Am. Chem. Soc. 1974, 96, 3438
[4] Pearson, A. J. Acc. Chem. Res. 1980, 13, 463



 前一篇文章
前一篇文章 下一篇文章
下一篇文章
