五氧化二釩〈Vanadium pentoxide〉
五氧化二釩〈Vanadium pentoxide〉
台北市立第一女子高級中學二年級李宛儒/台北市立第一女子高級中學化學科周芳妃老師修改/國立台灣師範大學化學系葉名倉教授責任編輯
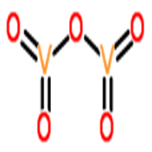
五氧化二釩的性質與結構
五氧化二釩〈Vanadium pentoxide〉化學式為V2O5,莫耳質量181.88 g mol−1,密度為3.357 g/cm3的橙色固體,熔點690 °C,沸點1750 °C,微溶於水,在水中的溶解度為0.8 g/100 mL (20 °C)。五氧化二釩有毒,不論是吸入、吞入、或是藉由皮膚吸收都有致命的危險。與一般金屬氧化物不同,溶於水呈酸性。由於加熱之後會放出氧氣,所以經常作為氧化反應的催化劑。五氧化二釩中的釩為最高的氧化態〈+5〉,具有兩性及氧化性。
五氧化二釩
圖片來源:http://www.chemspider.com/Record … 1-853f-3db8e1c62111
五氧化二釩的製備
其製備的方法為:先使釩礦石和鈉鹽反應,,再藉由加熱、溶劑萃取、使用硫酸酸化引起沈澱反應而得。例如:
2 NH4VO3 → V2O5(s) + 2 NH3 + H2O
五氧化二釩的兩性性質
五氧化二釩溶於非還原性酸中會生成含VO2+ 的淡黃色溶液,方程式如下:
V2O5 + 2 HNO3 → 2 VO2(NO3) + H2O
在過量鹼中可生成無色的釩酸鈉〈Na3VO4〉。酸度升高時,顏色變化為無色→橙色→紅色。
五氧化二釩的氧化還原反應
五氧化二釩為強氧化劑,以鹽酸〈HCl〉或氫溴酸〈HBr〉作還原劑,還原五氧化二釩中的正五價釩,產物可得藍色的VO(H2O)52+釩氧基離子及鹵素。例如:
V2O5(s) + 6 HCl + 7 H2O → 2 [VO(H2O)5]2+ + 4 Cl− + Cl2
若以草酸、一氧化碳或二氧化碳作還原劑,則可將固態的五氧化二釩還原成深藍色的二氧化釩固體。如果還原劑過量的話,最終產物是黑色的三氧化二釩。
以鋅汞齊〈zinc amalgam〉與五氧化二釩水溶液反應,可得到一系列各種顏色具有不同氧化態的水合離子,釩氧基與釩離子與顏色如下:
五氧化二釩的應用
五氧化二釩最重要的應用為使用接觸法制備硫酸時,作為二氧化硫氧化成三氧化硫的催化劑。而三氧化硫可進一步與水反應生成硫酸。
2 SO2 + O2 → 2 SO3
此反應於400-620°C時發生。低於此溫度時,五氧化二釩無法發揮催化功能;高於此溫度時,五氧化二釩則分解。反應的催化機制如下:
SO2 + V2O5(s) → SO3(g) + 2 VO2(s)
2 VO2(s) +1/2 O2(g) → V2O5
五氧化二釩的其他用途
1. 生產金屬釩、釩鐵合金、和其它釩基合金的中間產品
2. 製造釩催化劑的原料
3. 用於苯甲酸、鄰苯二甲酸等有機合成的催化劑
4. 製造彩色玻璃和陶瓷
參考資料:
http://www.dfmg.com.tw/safe/safe/7645.html
http://en.wikipedia.org/wiki/V2O5
http://zh.wikipedia.org/zh-tw/%E … 6%E4%BA%8C%E9%92%92



 前一篇文章
前一篇文章 下一篇文章
下一篇文章
