二氧化碳(Carbon Dioxide)
二氧化碳(Carbon Dioxide)
國立台灣師範大學化學研究所碩士生劉嘉倫/國立台灣師範大學化學系葉名倉教授責任編輯
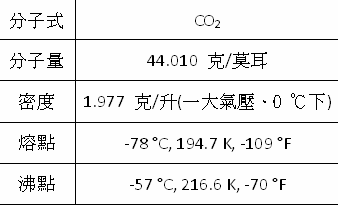
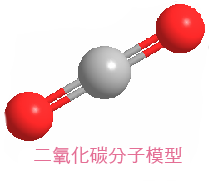
二氧化碳是由兩個氧原子共價鍵於一個碳原子所組成的化合物,化學式是CO2,在正常的溫度及壓力下是以氣體的形式存在。在低濃度時,二氧化碳是無色、無味的氣體,且不易燃。當吸入高濃度時,會感覺鼻子和咽喉有刺痛感,這是由於氣體溶解在粘膜和唾液,形成了微弱的碳酸。在標準溫度和壓力下,二氧化碳的密度大約是1.98 kg/m3,約為空氣的1.5倍,二氧化碳分子是線型結構包含兩個雙鍵。
在一大氣壓、溫度- 78 ℃下二氧化碳會直接沉積成固態,當溫度一上升時就會直接從固態昇華為氣態,而不會產生液體,所以我們稱固態的二氧化碳為乾冰。它是在1825年首次被一個法國化學家Charles Thilorier發現,由於乾冰的溫度非常低,所以常被用來保持物體的冷凍或低溫狀態,而且相對來說比較便宜,所以常常可以在食品包裝、實驗室甚至於航運業看到它被廣泛運用。
二氧化碳是第一個被描述不同於空氣的物質,十七世紀,荷蘭化學家Jan Baptist van Helmont發現當他在一個密閉容器內燃燒木炭,燃燒完的木炭重量遠低於原來的木炭,他解釋說相差的重量是木炭已經轉變成一種無形的物質,它稱之為”氣體”。在1750年,一個蘇格蘭的醫生Joseph Black更徹底的研究了二氧化碳的特性,他發現將石灰岩(碳酸鈣)加熱或和酸反應會產生一種它稱為”固定空氣”的氣體,他指出,固定空氣的密度高於空氣而且不助燃,Black還發現將此氣體通過石灰(氫氧化鈣)水溶液,會有碳酸鈣沉澱。
二氧化碳是大氣中最豐富的氣體之一,在植物和動物進行光合作用或呼吸作用時扮演重要的角色。綠色植物在進行光合作用時將二氧化碳和水轉換成葡萄糖和氧氣:
C6H12O6+ 6 O2→ 6 CO2 + 6 H2O
二氧化碳的製備有很多種方法,例如將鹽酸和碳酸鈣反應:
2 HCl + CaCO3 → CaCl2 + H2CO3
然後H2CO3會分解成水和二氧化碳,這種方法被廣泛運用在工業合成上,因為他們可以用來中和廢酸液。另外在生產生石灰(氧化鈣)的過程中也會產生二氧化碳,將石灰石加熱約850 ℃:
CaCO3→ CaO + CO2
燃燒含碳燃料如甲烷、石油蒸餾物(汽油、柴油、煤油、丙烷),還有煤炭和木材也會產生二氧化碳和水,用甲烷當例子其化學反應式為:
CH4+ 2 O2 → CO2 + 2 H2O
鐵氧化物和焦碳在高爐中進行氧化還原反應產生生鐵和二氧化碳:
2 FeO3 + 3 C → 4 Fe + 3 CO2
酵母代謝糖後產生二氧化碳和酒精:
C6H12O6 →2 CO2 + 2 C2H5OH
所有好氧生物體在氧化細胞中碳水合物、脂肪酸和蛋白質時都會產生二氧化碳,大部分的反應是極其複雜而且不易描述的。
二氧化碳可以改變水的PH值,它的原理是二氧化碳會略溶於水形成碳酸:
CO2 + H2O → H2CO 3
然後碳酸在水中會進行可逆反應產生陽離子和碳酸氫根離子:
這種化學行為解釋了為什麼當水暴露在空氣中後會由中性pH值7變成酸性pH值5.5。
二氧化碳也是溫室氣體之一,近年來人類活動大大增加了大氣中二氧化碳和其他溫室氣體的濃度,使的地球上溫室效應加強,而造成全球暖化,為了制止這種現象愈趨嚴重,現在各國都在提倡降低溫室氣體的排放。



 前一篇文章
前一篇文章 下一篇文章
下一篇文章
