中間體與穩定狀態近似法
中間體 (Intermediates)與穩定狀態近似法 (Steady State Approximation)
國立臺灣大學化學博士林雅凡/ 東京大學理學博士陳藹然責任編輯
最近臺灣學術團隊成功捕捉測量到「克里奇中間體」,並進一步發現此中間體在約千分之一秒內,就可能與水蒸氣分子產生反應。這個研究成果因為多項有價值的突破性發現,入選Science雜誌,成為大氣化學動力學的指標性研究之一。也因為這振奮人心的成果,使「克里奇中間體 (Criegee Intermediates,簡稱CIs)」成為科技界當紅炸子雞,媒體爭相報導,希望以最親民的語彙使普羅大眾能了解這項科學成就,其中有編採者以「快閃神祕分子」來描述「克里奇中間體」。
用「快閃」來描述反應中間體的確傳神逼真,因為反應中間體是化學反應進行過程中曾經產生,又在形成後隨即消耗轉變的物種,生命期 (Lifetime) 十分短,不會存在於化學總反應中,反應過程間也不易被觀測。要了解一反應的中間體,必須先了解其反應機制 (Reaction Mechanisms)。在化學中,描述由反應物轉變為產物的過程稱為反應機制,而這些機制一如毛毛蟲蛻變為蝴蝶的歷程般,並非「一步登天」,乃經過許多變化階段,在這些階段中,若非經過特殊的設計,並不容易直接觀察了解其生命的狀態 (如成蛹時期的變化)。
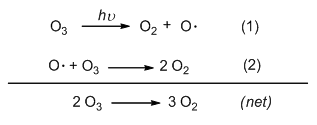
化學反應也是如此,其機制經過一個基礎步驟 (elementary step),使起始物反應為中間體,短暫形成的中間體很快又經過第二個基礎步驟反應為第二個中間體,以此類推逐步形成最終產物。所以中間體是反應機制中其中一基礎步驟的生成物,此生成物又在接下來的基礎步驟中扮演反應物角色而被消耗,如此一長一消的情況下,中間體不存在於最終淨反應中。如臭氧分子(O3) 受紫外光照射形成氧分子 (O2) 的反應機制即是牽涉兩個基礎步驟:
第一個基礎步驟為臭氧分子照光被分解為氧分子與氧自由基,氧自由基隨即在第二個基礎步驟中扮演反應物角色,與臭氧分子反應形成2倍當量氧分子。氧自由基即是此反應的中間體,只在反應中間過程出現,卻不表現在淨反應中。雖在終極產物中無法得到在中途已被消耗殆盡的氧自由基中間體,卻能透過實驗與儀器的精密設計攫獲測量中間體,記錄其短暫生命期的歷史。
不過如何找到正確的反應機制,進一步偵測中間體? 那就得靠化學動力學的分析佐證,了解其反應速率定律 (Rate Law),以得到反應過程的資訊。最常被使用來推論速率定律的方法之一為穩定狀態近似法 (Steady State Approximation)。所謂穩定狀態是指物種之生成速率等於消耗速率,致使濃度保持定值,而「濃度變化」趨近零的狀態,可以數學式 d[物種]/dt=0表示。
基於中間體的短暫生命期–生成後立即消耗的特性,可將其假設為濃度保持定值的穩定狀態,因此常藉由穩定狀態近似法的帶入,來探討各物種濃度與時間的關係,藉此了解該反應的速率定律與反應機制。值得一提的是,穩定狀態近似法並非適用於所有中間體,而有可能得到與實驗結果不符的速率定律,因此中間體是否適合以穩定狀態來描述,仍需透過實驗來檢驗,而不能將中間體視為理所當然的穩定狀態。
參考資料與延伸閱讀
- Wikipedia: Reaction Intermediate, Steady State
http://en.wikipedia.org/wiki/Reaction_intermediate
http://en.wikipedia.org/wiki/Steady_state_%28chemistry%29 - Driving Law Using the Steady State Approximation
http://www.science.uwaterloo.ca/~cchieh/cact/c123/steadyst.html
http://www.science.uwaterloo.ca/~cchieh/cact/c123/steadys2.html - cK-12 Foundation: Intermediate
http://www.ck12.org/chemistry/Intermediate/lesson/Intermediate/?referrer=concept_details - Upadhyay, S. K. Chemical Kinetics and Reaction Dynamics. New York: Springer, 2006
- Steinfeld, J. I.; Francisco, J. S.; Hase, W. L. Chemical kinetics and dynamics. Upper Saddle River, N.J.: Prentice Hall, 1999.
- Porter, M. C.; Skinner, J. B. Chem. Edu., 1976, 53, 366


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
