生命科學
腦神經的無用之用
腦神經的無用之用
知識通訊評論第120期
神經科學近年的主流思維,是探索人類某些工作與腦部某些活動的關聯性。但是腦部即使在不工作的休息狀態,也保持著一定活動的事實,不但挑戰了工作與腦部活動關聯的主流思維,也深刻顯現出人類腦部機制的複雜性。
對於自願參加實驗者來說,腦部掃描實驗並不是件輕鬆的差事。研究人員通常會要求受測者要做點什麼事情;比方說解數學題、尋找記憶中看過的臉孔或是想著最喜歡的政治領袖,同時觀察他們做這些事情時的腦部反應。
但過去幾年間,有些研究人員已開始認為無須全然遵循此種研究標準程序。雖然受測者仍要躺在功能性磁振造影(fMRI)掃描器中,但研究人員會要求受測者試著放空心思,目的是要看看大腦閒置時,會發生什麼狀況。結果卻是,有很多事情發生。
大腦中有些迴路必須一直保持活動狀態,因為他們控制著人體的自律功能,像是呼吸及心跳等。但在人類思索伙食採買清單、重新處理對話及只是做白日夢時,大腦的其他大部分區域仍持續工作。大腦如此活動型態,一般稱之為休息狀態,神經科學家已經找到證據,顯示在此狀態下和從事活動狀態下的腦部神經網路,看起來非常相似。
如果有任何指標可以衡量休息狀態中腦部使用能量的數量,就可突顯出休息狀態活動的重要性。在休息狀態中腦部的血流量,比在腦部從事活動實驗中,通常只少了百分之五到百分之十。研究休息狀態的大腦應有助於找出積極活動的大腦是如何運作。研究休息狀態神經網路,有利於比對出大腦的內在連結,例如解讀大腦不同區域之間,那些區域常有互相對話的情形,人類罹患疾病時,這些對話模式又會有何種差異。
但是所有大腦的活動究竟為何產生?若要神經科學家,即使是專門研究休息狀態的神經科學家回答這個問題,他們之中許多人的反應,會是搖頭嘆息或聳肩表達不知道答案。加拿大蒙特婁市麥吉爾大學腦部影像專家舒繆爾(Amir Shmuel)表示,「有關這方面的研究,我們還在初始階段,大部分的論點僅只是假說」。休息狀態大腦活動,可能會讓連結在大腦不用時持續運作。又或者休息狀態大腦活動,可能有助於支持大腦對未來刺激產生反應,或者是維持通常會合作完成一件工作的大腦不同區域間的連繫。休息狀態大腦活動,甚至可以整合從正常活動中累積的記憶或吸收的資訊。
史丹福大學神經科學家葛瑞休斯(Michael Greicius)指出,「對於休息狀態大腦活動的研究,各界躍躍欲試殷殷企盼,但是這方面的基礎知識卻很貧乏」。
保持活動性
依據一九九○年代中期進行的一系列實驗結果,首次結論大腦從來不會真正休息。密爾瓦基威斯康辛醫學院博士生畢斯瓦爾(Bharat Biswal) ,曾試著找出能夠鑑別及排除fMRI掃描產生背景訊號的方法,希望藉此提升對所得到訊號的解讀力。畢斯瓦爾目前在紐澤西理工學院擔任生物醫學工程師,他表示,「我們原來假設這些訊號都是雜訊。」但是他觀察受測者休息狀態接受掃描的訊號,卻顯示與平常一樣、低度波動頻率的腦波擾動。畢斯瓦爾的實驗認為那些擾動是神經元活動所造成。
在研究大腦休息狀態活動的早期,有些人認為已有了重大發現。葛瑞休斯表示,「我第一次研究這些網路時,我十分確信我們已經開始解答有關人類意識的一連串迷團,而且這是一個即時、持續進行的認知過程。但是,我很快就領悟到這種看法是錯誤的」。後續研究顯示,在像是睡眠或麻醉等其他狀態下,活動的神經網路也會出現,所以這些網路活動不必然與認知過程相關。
老爸爸的遺傳風險
「抗自由基」保健品有害?
禽流感病毒 (H5N1) 能不能由空氣傳染哺乳動物?一個現代潘朵拉盒子的爭議!
禽流感病毒 (H5N1) 能不能由空氣傳染哺乳動物?一個現代潘朵拉盒子的爭議!
長庚大學生物醫學系周成功教授
禽流感病毒 (H5N1) 平時只在家禽鳥類間散佈,不會造成宿主死亡。1996年第一個會感染人的變種病毒出現在廣東。現在知道這個病毒至少發生了三次基因突變,使得它能在人體內繁殖! 兩個突變發生在病毒表面與宿主細胞結合的蛋白,讓病毒可以和人類細胞結合。另一個突變則發生在負責病毒RNA複製的酵素。正常H5N1病毒感染體溫較高的腸胃道細胞,但是這個突變使得酵素在體溫較低的上呼吸道細胞仍然得以複製病毒RNA。
WHO迄今記錄606人曾感染H5N1,而死亡人數高達357人[1]。雖然H5N1感染人類的致死率如此高,但H5N1仍然只能透過親密接觸才會感染人。為什麼H5N1不能透過空氣飛沬傳染人?H5N1真的完全沒辦法透過空氣飛沬傳染人嗎?如果讓它在人體內不斷繁殖,它會不會演化出新的變種,而可以透過空氣飛沬傳染?
 荷蘭的病毒學家Fouchier為了要回答這個問題,設計了一個非常簡單的實驗。他首先準備了一株帶了3個特定基因突變,能感染哺乳動物的H5N1。再將這個病毒接種感染一隻雪貂,然後連續不斷地透過接種傳染到下一隻。每次接種感染後,就分離出新產生的病毒,接著測試這些病毒會不會透過空氣飛沬傳染給隔壁籠子裡的雪貂?實驗的結果很清楚:經過10次接種傳染後,H5N1真的可以藉由空氣飛沬傳染別隻的雪貂!
荷蘭的病毒學家Fouchier為了要回答這個問題,設計了一個非常簡單的實驗。他首先準備了一株帶了3個特定基因突變,能感染哺乳動物的H5N1。再將這個病毒接種感染一隻雪貂,然後連續不斷地透過接種傳染到下一隻。每次接種感染後,就分離出新產生的病毒,接著測試這些病毒會不會透過空氣飛沬傳染給隔壁籠子裡的雪貂?實驗的結果很清楚:經過10次接種傳染後,H5N1真的可以藉由空氣飛沬傳染別隻的雪貂!
可能廣泛治療類澱粉蛋白沉積(amyloidosis)引起之神經性疾病的「萬用藥物」
可能廣泛治療類澱粉蛋白沉積(amyloidosis)引起之神經性疾病的「萬用藥物」
國立臺灣師範大學生命科學系李冠群副教授
類澱粉蛋白(amyloids ) 是一種不可溶的纖維狀蛋白質,名稱的由來是因為早期碘染色(iodine-staining)技術尚不成熟,使得科學家誤以為它是一種澱粉(拉丁文為amylum)。當時科學界一直在爭論它到底是屬於脂肪沈澱物,或是碳水化合物沈澱物,直到最後,才發現它其實是一種蛋白質。當類澱粉蛋白不正常地在器官中堆積時,會造成類澱粉沉積症(amyloidosis)。目前已知在人體內至少有18種蛋白質,會因為其蛋白結構錯誤折疊,導致與本身或與細胞內其他蛋白質發生糾結,形成纖維狀的類澱粉蛋白沉積。在阿茲海默症(AD)和帕金森氏症等多種神經性疾病患者的神經系統中,都可以觀察到大量類澱粉蛋白的沉積,因此,許多學者相信它可能是導致腦部或其他器官功能退化或功能障礙的原因。
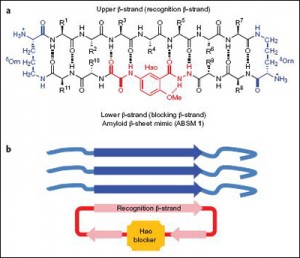
美國加州大學歐文分校的詹姆斯諾維克教授(James Nowick of the University of California, Irvine)和洛杉磯分校的大衛艾森伯格教授(David Eisenberg of the University of California, Los Angeles)所領導的研究團隊,已經共同研製出一種環狀胜肽類的模板分子,它可誘導多種胜肽形成β-褶板結構(β-sheet structures)。在體外的試驗中,這些β-褶板結構可以阻斷包括amyloid-β (簡稱Aβ)、tau和α-synuclein等多種蛋白的沉積,也可減少Aβ在細胞造成的毒性,而Aβ與tau正是阿茲海默症的致病蛋白質;α-synuclein則是帕金森氏症的致病蛋白質,因此,該種新型蛋白沉積抑制劑,在同時治療多種神經性疾病上具有極大的潛力。此結果已發表在2012年9月線上的《自然化學》(Nature Chemistry)期刊。
2000年,諾維克的研究團隊合成出帶有一種稱為“Hao”的人造氨基酸的環狀胜肽,發現每兩個這種胜肽會自行形成β-褶板的結構(dimer),但不會進一步形成聚集沉積。由於在阿茲海默症患者和前額葉癡呆(frontotemporal dementia)患者等的腦內,tau蛋白會形成β-褶板結構,並會進一步形成聚集沉積,造成神經纖維纏結(neurofibrillary tangles),於是科學家們嘗試納入tau蛋白片段,結果發現這種環狀分子會抑制tau蛋白衍生片段的聚集。然而,若將此法應用於Aβ蛋白,則阻止聚集的效果很微弱,這可能是因為含有Aβ蛋白片段的環狀分子太小之故。2012年,Nowick實驗室的博士班研究生Pin-Nan Cheng(來自台灣的鄭彬南,也是該篇研究論文的第一作者)和艾森伯格研究團隊的成員,以含有“Hao”的環狀胜肽為模板,創造出新型較大的環狀分子,該分子同樣能形成β-褶板構造,並可有效防止Aβ聚集,以及降低類澱粉蛋白聚集體的毒性。該團隊甚至將此環狀分子模板納入其他會導致類澱粉沉積症(amyloidosis) 的蛋白片段,例如tau、α-synuclein、第二型糖尿病有關的胰島類澱粉蛋白等,發現也有抑制聚集的效用(參見下圖)。
目前Nowick研究團隊只在生物體外測試了這些新型阻斷劑,他們對這些阻斷劑如何彼此作用、如何和正在聚集的蛋白質作用,以及蛋白質如何形成寡聚體(oligomers)深感興趣,最終將會把類似的阻斷劑分子引到模式動物中進行測試。此研究對於尋找更普遍阻斷不同蛋白聚集的新型阻斷劑而言,是邁出了一大步。
至於這類阻斷劑分子是否能成為阻止蛋白聚集的良好藥物,仍有待觀察。過去,曾有研究人員進行臨床試驗,測試某些Aβ聚集阻斷劑的效果,結果效用不大,例如Scyllo-inositol (又名 ELND005)是一種可阻止Aβ聚集的植物性糖醇,它能控制阿茲海默症轉基因小鼠的認知能力下降,但在第2階段人體臨床試驗中,對於輕度至中度阿茲海默症患者來說,並沒有提高這些患者的認知功能。另一種Aβ聚集抑製劑-Alzhemed(又名tramiprosate),雖然通過第2階段的臨床試驗,但在第3階段的阿茲海默症試驗中,並未出現臨床療效。
(本文由國科會補助「新媒體科普傳播實作計畫」執行團隊撰稿)
原文首刊載於國科會科技大觀園科技新知
尋找保護性的基因突變:為什麼有人不會得阿茲海默症?
尋找保護性的基因突變:為什麼有人不會得阿茲海默症?
長庚大學生物醫學系周成功教授
許多遺傳性疾病都是因為基因突變,造成蛋白質胺基酸序列改變,使得蛋白質功能喪失而得病。但有沒有人會因為攜帶了特定的基因突變,反而不容易罹患特別的疾病?找到這些保護性的基因突變,可以讓我們更瞭解疾病的成因,發展有效的預防或治療的藥物。透過大規模基因定序與病歷資料庫的分析,最近發現的確有些基因突變能保護老年人不容易得到阿玆海默症。
 阿茲海默症又稱老年失智症,主要病徵就是認知和記憶能力逐漸喪失,它發生的機會與年齡成正比;過了65歲,每5年發病率會增加一倍。迄今仍無有效的治療方式。造成疾病確實的原因還不完全清楚,不過許多証據都指向一個蛋白:amyloid β precursor (APP)。APP是神經細胞上的一個膜蛋白,真正的生理功能並不清楚。它會被酵素切出一小段蛋白,稱作 β amyloid。β amyloid自己很容易聚集成塊。解剖阿茲海默症病人的腦子,會看到神經組織中有許多 β amyloid聚集的斑塊。β amyloid形成的斑塊是判定阿茲海默症一個重要標記。
阿茲海默症又稱老年失智症,主要病徵就是認知和記憶能力逐漸喪失,它發生的機會與年齡成正比;過了65歲,每5年發病率會增加一倍。迄今仍無有效的治療方式。造成疾病確實的原因還不完全清楚,不過許多証據都指向一個蛋白:amyloid β precursor (APP)。APP是神經細胞上的一個膜蛋白,真正的生理功能並不清楚。它會被酵素切出一小段蛋白,稱作 β amyloid。β amyloid自己很容易聚集成塊。解剖阿茲海默症病人的腦子,會看到神經組織中有許多 β amyloid聚集的斑塊。β amyloid形成的斑塊是判定阿茲海默症一個重要標記。
1987年科學家發現早發性家族遺傳的阿茲海默症患者,帶了APP基因的特定突變,確立了兩者之間的關係。但從APP到 β amyloid的斑塊,是造成阿茲海默症的原因?還是病發後的結果,一直沒有定論。
雖然人老之後容易得阿茲海默症,但為什麼仍有許多老人完全沒有失智的困擾?會不會這些人帶著一些未知但會保護神經老化的基因?為了回答這個問題,冰島的科學家首先分析了1,795位冰島居民完整的基因組序列和就醫記錄,結果發現千分之五的冰島人身上APP基因第673個胺基酸會從alanine突變成threonine。接下來再用400,000名北歐人的檢體作全面的檢測,發現帶了這個APP基因突變的人與一般人相比,有5倍的機會活到85歲而沒有罹患阿茲海默症。
這個673胺基酸發生突變的APP蛋白比較不容易被酵素切出 β amylod!這個特性解釋了它的保護機制,同時也進一步証實APP產生 β amyloid是造成阿茲海默症的原因。對大多數正常人來說,可以減少 β amyloid的方法,就是去找可以抑制切割APP那個酵素活性的藥物。目前有好幾家藥廠正在發展這種酵素抑制劑,有的己經進入一期臨床實驗。
基改作物的加州標籤戰
基改作物的加州標籤戰
知識通訊評論第119期
基改作物是否應該標示,已經在加州成為耗費金錢的戰爭,贊成反對陣營莫不傾囊以赴。基改作物減少的農藥需求,是否真帶來裨益,也引起爭論。
加州基因改造食品爭議已轉為一場所費不貲的戰爭。農業相關企業和食品商八月中承諾投入一千三百萬美金,支持反對標示基因改造食品提案的陣營。反對陣營資金充裕,累積高達兩千五百萬,足以支付十一月公民投票前數個月的遊說活動。反觀「三十七號提案」的支持者,包括有機農戶和環保份子,目前只爭取了不到兩百五十萬美金。
支持標示的人主張,民眾有知的權利,並強調食品安全上的顧慮,以及大眾對企業農產利益抱持的不信任態度。反對者認為標示有如警告,會增加消費者對基因技術的敵意。他們認為那會使食物價格上揚,增加零售商、農戶和食品商誤標導致無謂訴訟的風險。
類似提案雖然在其他州闖關失敗,但若能在加州獲得成功,將可成為全國的先例。奧勒岡州特洛伊市的有機農業宣導組織「有機中心」首席科學顧問班布魯克(Charles Benbrook)認為,提案一旦通過,無疑將成為美國公眾行動的轉折點。
食品標示必然會造成深遠的影響,因為根據美國農業局統計,美國約有百分之九十四的大豆和百分之八十八的玉米透過基因改造,來增加抗農藥以及抗蟲害能力。這項計畫將影響上萬品牌商品,包括可口可樂、百事、和雀巢各自投入超過一百萬美金支持反對陣營。杜邦和孟山都等農業相關企業,也各自出資超過四百萬。
標示本身並不指出作物是如何被改造,也不會顯示食物中基因改造成份的含量。基因作物飼養動物的肉類,也不需要加以標示。
有了它,類澱粉蛋白不再沉積
有了它,類澱粉蛋白不再沉積
國立臺灣師範大學生命科學系副教授李冠群/國立臺灣師範大學生命科學系副教授李冠群責任編輯
 類澱粉蛋白(amyloids ) 是1種不可溶的纖維狀蛋白質,名稱的由來是因為早期碘染色(iodine-staining)技術尚不成熟,使得科學家誤以為它是1種澱粉(拉丁文為amylum)。當時科學界一直在爭論它到底是屬於脂肪沉澱物,或是碳水化合物沈澱物,直到最後,才發現它其實是1種蛋白質。當類澱粉蛋白不正常地在器官中堆積時,會造成類澱粉沉積症(amyloidosis)。
類澱粉蛋白(amyloids ) 是1種不可溶的纖維狀蛋白質,名稱的由來是因為早期碘染色(iodine-staining)技術尚不成熟,使得科學家誤以為它是1種澱粉(拉丁文為amylum)。當時科學界一直在爭論它到底是屬於脂肪沉澱物,或是碳水化合物沈澱物,直到最後,才發現它其實是1種蛋白質。當類澱粉蛋白不正常地在器官中堆積時,會造成類澱粉沉積症(amyloidosis)。
目前已知在人體內至少有18種蛋白質,會因為其蛋白結構錯誤折疊,導致該蛋白質會與其本身、或與細胞內其他蛋白質發生糾結,形成纖維狀的類澱粉蛋白沉積。在阿茲海默症和帕金森氏症等多種神經性疾病患者的神經系統中,都可以觀察到大量類澱粉蛋白的沉積,因此,許多學者相信它可能是導致腦部或其他器官功能退化或功能障礙的原因。
美國加州大學歐文分校的詹姆斯‧諾維克教授(James Nowick of the University of California, Irvine)和洛杉磯分校的大衛‧艾森伯格教授(David Eisenberg of the University of California, Los Angeles)所領導的研究團隊,已經共同研製出1種環狀胜肽類的模板分子,它可誘導多種胜肽形成β-褶板結構(β-sheet structures)。在體外的試驗中,這些β-褶板結構可以阻斷包括amyloid-β (簡稱Aβ)、tau和α-synuclein等多種蛋白的沉積,也可減少Aβ在細胞造成的毒性,而Aβ與tau正是阿茲海默症的致病蛋白質;α-synuclein則是帕金森氏症的致病蛋白質,因此,該種新型蛋白沉積抑制劑,很可能成為廣泛治療類澱粉蛋白沉積症的「萬用藥物」,在同時治療多種神經性疾病上具有極大的潛力。此結果已發表在2012年9月線上的《自然化學》(Nature Chemistry)期刊。
老年失智症的防火牆-基因突變
老年失智症的防火牆-基因突變
長庚大學生物醫學系教授周成功/長庚大學生物醫學系教授周成功責任編輯
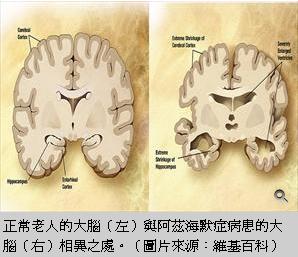 許多遺傳性疾病都是因為基因突變,造成胺基酸序列改變,使得蛋白質功能喪失而得病。但有沒有人會因為攜帶了特定的基因突變,反而不容易罹患特別的疾病?找到這些保護性的基因突變,可以讓我們更了解疾病的成因,發展有效的預防或治療的藥物。透過大規模基因定序與病歷資料庫的分析,最近發現的確有些基因突變能保護老年人不容易得到阿玆海默症。
許多遺傳性疾病都是因為基因突變,造成胺基酸序列改變,使得蛋白質功能喪失而得病。但有沒有人會因為攜帶了特定的基因突變,反而不容易罹患特別的疾病?找到這些保護性的基因突變,可以讓我們更了解疾病的成因,發展有效的預防或治療的藥物。透過大規模基因定序與病歷資料庫的分析,最近發現的確有些基因突變能保護老年人不容易得到阿玆海默症。
阿茲海默症又稱老年失智症,主要病徵就是認知和記憶能力逐漸喪失,它發生的機會與年齡成正比;過了65歲,每5年發病率會增加1倍。迄今仍無有效的治療方式。造成疾病確實的原因還不完全清楚,不過許多證據都指向1個蛋白:amyloid b precursor (APP)。APP是神經細胞上的1個膜蛋白,真正的生理功能並不清楚。它會被酵素切出一小段蛋白,稱作 b amyloid。b amyloid自己很容易聚集成塊。解剖阿茲海默症病人的腦子,會看到神經組織中有許多 b amyloid聚集的斑塊。b amyloid形成的斑塊是判定阿茲海默症1個重要標記。