鋅碳電池 (Zinc-carbon Battery) 與鹼性電池 (Alkaline Battery)
國立臺灣大學化學系黃俊誠博士/國立臺灣大學化學系陳藹然博士責任編輯
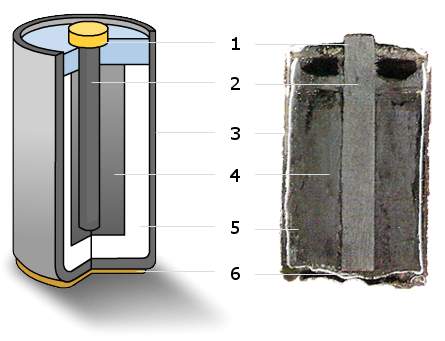
鋅碳電池,又稱鋅碳乾電池、碳性電池、碳性電芯,外殼由鋅構成。第一個商用乾電池是由法國科學家勒克朗社(G. Leclanché, 1839-1882)所發明,電池的陽極是鋅罐。陰極是一支碳棒(石墨棒),碳棒是惰性電極,只作為電子的通路,本身沒有直接參與化學反應。兩電極之間填滿了氯化銨(NH4Cl)為電解質、二氧化錳(MnO2)和氯化鋅(ZnCl2)的飽和溶液以及一些惰性漆料濕漿糊(圖1)。當電極被連接時,陽極的鋅即被氧化就失去電子(e–)。失去的電子便經由電線跑到陰極,使NH4Cl中解離出的NH4+離子還原成NH3,同時也形成氫氣。釋出的氫再被二氧化錳所氧化,而NH3則被利用形成錯合物Zn(NH3)2Cl2。
陽電極上發生的氧化作用:
Zn(s) → Zn2+ (aq) + 2e–
陰電極上發生的還原作用:
2NH4+ (aq) + 2e– → 2NH3(aq)+H2(g) 2MnO2(s) + H2(g) → Mn2O3(s) + H2O(l)
鋅離子則與氨反應,生成錯合物:
Zn2+ (aq) + 2NH3(aq) + 2Cl–(aq) → Zn(NH3)2Cl2
電池內的整體反應:
2MnO2(s) + 2NH4Cl(aq) + Zn(s) → Zn(NH3)2Cl2 + Mn2O3(s) + H2O(l)
鋅碳電池的電壓為1.5 V,這種電池適用於只需少量電流的電器。此電池至少有兩個缺點,第一若電池放電太快便不能及時除去生成的氣體,令電壓減低,要暫停使用一會,電壓才能恢復到原來的水平;此外這種電池的壽命亦較短,這是因為除了鋅電極放電時會反應之外,電池在未使用時,酸性氯化銨也會與鋅電極發生作用。一段時間後鋅外殼會變薄,電池內的糊狀化學藥品便會泄出,因此在電池外常加上一層鋼製或膠製的外殼,防止與大氣作用,亦可防止糊狀化學藥品泄出。

