鎳鎘電池(Nickel-cadmium Battery)
鎳鎘電池(Nickel-cadmium Battery)
國立台灣大學化學系黃俊誠博士/國立台灣大學化學系陳藹然博士責任編輯
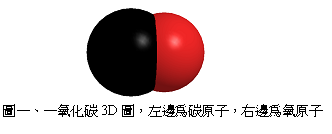
鎳鎘電池是一種使用氫氧化亞鎳(Nickel oxyhydroxide;NiOOH)與金屬鎘(Cd)為電極的蓄電電池,最早於1899年由瑞典的的渥德莫‧甄格(Waldemar Jungner, 1869-1924)發明。在此之前,鉛酸電池是唯一能重複使用的蓄電池。其電池主要構造原理為:位於陽極的鎘和氫氧化鈉(NaOH)中的氫氧根離子(OH–)反應成氫氧化鎘,並附著在陽極上,同時產生電子;電子沿著電線至陰極,和陰極的氫氧化亞鎳反應形成氫氧化鎳(Ni(OH)2),氫氧化鎳附著在陰極上。因為在陽極半反應中消耗掉的氫氧根離子,在陰極半反應中又產生,故氫氧化鈉溶液濃度不會隨著時間而下降。反應式如下: