能量
鎳鎘電池(Nickel-cadmium Battery)
鎳鎘電池(Nickel-cadmium Battery)
國立台灣大學化學系黃俊誠博士/國立台灣大學化學系陳藹然博士責任編輯
鎳鎘電池是一種使用氫氧化亞鎳(Nickel oxyhydroxide;NiOOH)與金屬鎘(Cd)為電極的蓄電電池,最早於1899年由瑞典的的渥德莫‧甄格(Waldemar Jungner, 1869-1924)發明。在此之前,鉛酸電池是唯一能重複使用的蓄電池。其電池主要構造原理為:位於陽極的鎘和氫氧化鈉(NaOH)中的氫氧根離子(OH–)反應成氫氧化鎘,並附著在陽極上,同時產生電子;電子沿著電線至陰極,和陰極的氫氧化亞鎳反應形成氫氧化鎳(Ni(OH)2),氫氧化鎳附著在陰極上。因為在陽極半反應中消耗掉的氫氧根離子,在陰極半反應中又產生,故氫氧化鈉溶液濃度不會隨著時間而下降。反應式如下:
鉛蓄電池
鉛蓄電池 (Lead-acid Battery)
國立臺灣大學化學系黃俊誠博士/國立臺灣大學化學系陳藹然博士責任編輯
1829年法國物理學家貝克勒(Alexandre-Edmond Becquerel,1788-1878)製造出一個能稍微產生穩定電流的金-硫酸銅電池,他的學生蒲朗第(Gaston Planté,1834-1889)於1859年所發明世界上第一個實用的鉛蓄電池。剛開始由於初期的鉛蓄電池加工成型過程冗長難以大量生產,因而不受重視。直到1881年法國科學家福耳(Camille Alphonse Faure,1840-1898)將電池設計做了重大改進,把氧化鉛(Pb3O4)直接塗佈於鉛板上,才讓鉛蓄電池開始得以商業化。鉛蓄電池可在短時間內大量放電,且長時間放電電壓穩定,也沒有鹼性電池的記憶效應缺點。現今鉛蓄電池多用於汽、機車等交通工具,近年來更發展出各種不同用途,如可在水中和在低溫下使用的電池,更使其使用範圍增大,對我們愈來愈重要。
鎳氫電池(Nickel-metal Hydride Battery)
鎳氫電池(Nickel-metal Hydride Battery)
國立台灣大學化學系黃俊誠博士/國立台灣大學化學系陳藹然博士責任編輯
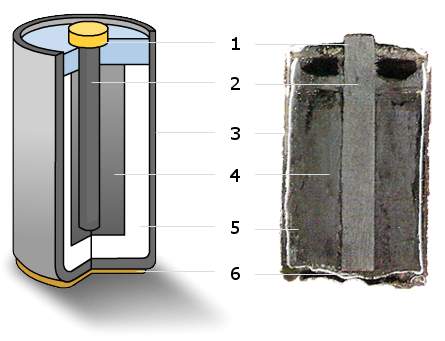
鎳氫電池(Nickel-metal Hydride Battery或Nickel-metal Hydride Cell)的縮寫為NiMH,以吸附式氫氣合金電極為陽極,取代鎳鎘電池中的鎘金屬,如同鎳鎘電池,其陰極電極為氫氧化亞鎳(Nickel oxyhydroxide;NiOOH)。(圖一)由於此合金可吸收高達本身體積100倍的氫,儲存能力極強。和鎳鎘電池相比,兩者皆為1.2伏特電壓;鎳氫電池的電池容量(Capacity)約為鎳鎘電池的2-3倍,具低記憶效應與高自放電(Self-discharge)特性,可在一小時內再充電,內阻較低,一般可進行500次至1000次的充放電循環。但是與鋰電池比較,鎳氫電池的體積能量密度較低,行放電較高,且較高的記憶效應。因為鎳氫電池不含鎘,並且無鎘重金屬污染之虞,被譽為最環保的電池。
鋰電池(Lithium Battery)
鋰電池(Lithium Battery)
國立臺灣大學化學系黃俊誠博士/國立臺灣大學化學系陳藹然博士責任編輯
鋰電池的研究最早是在1912年由Gilbert Newton Lewis開始進行鋰離子電池之研究,真正上市的第一顆鋰電池是在1970年上市,但是它不能重複充電使用,為一次性鋰電池。一次性鋰電池以金屬鋰為陽極,碘為陰極,碘化鋰為電解質。鋰電池早期用於心律調整器,可維持十幾年的壽命。其反應方程式如下:
陽極反應:2Li(s) + 2I–(aq) → 2LiI(s) + 2e–
陰極反應:I2(l) + 2e– → 2I–(s)
總反應:2Li(s) + I2(l) → 2LiI(s) 總電位 = 3.0 伏特
可重複使用鋰電池的開發是自1980年英國谷登拿(John B. Goodenough, )教授發表鋰鈷電極材料的論文開始,1991年日本Sony公司正式推出鋰離子二次電池商品。二次鋰電池特點為能量密度高、操作電壓高、輸出功率大、放電平穩、工作溫度區間大、充放電循環可達500次以上、自放電低、儲存壽命長,被視為目前最主要的二次電池。
水銀電池(Mercury Battery)
水銀電池(Mercury Battery)
國立台灣大學化學系黃俊誠博士/國立台灣大學化學系陳藹然博士責任編輯
水銀或稱汞電池,形狀大小如一般的鈕扣,因此又稱鈕扣電池。它屬於不可充電的一次化學電池。雖說早在100年前便已熟知的氧化汞-鋅電池系統,但一直未被廣泛使用。1942年由金頂(Duracell)電池的創立者,山謬•魯本(Samuel Ruben)與Mallory公司於二次大戰期間共同開發出第一個放電平穩的水銀電池。和多數發明一樣,初期只使用在金屬探測器、軍需品與軍用無線電的手提電話等軍事用途上,到了戰後才逐漸被民間廣泛地使用,例如小型的電子裝置心臟起搏器(cardiac pacemaker)等。水銀電池壽命可長達十年之久,電壓約維持在1.35伏特。大多數電池的電位會隨電池放電而下降,尤其是到使用壽命的末期時這個現象會特別明顯,而水銀電池即使是在電池壽命即將終了之時,仍可保有穩定之電壓。但因其價格較高,且含汞,有環境汙染的問題,目前已減少使用,甚至有些國家已禁用。
鋅碳電池與鹼性電池
鋅碳電池 (Zinc-carbon Battery) 與鹼性電池 (Alkaline Battery)
國立臺灣大學化學系黃俊誠博士/國立臺灣大學化學系陳藹然博士責任編輯
鋅碳電池,又稱鋅碳乾電池、碳性電池、碳性電芯,外殼由鋅構成。第一個商用乾電池是由法國科學家勒克朗社(G. Leclanché, 1839-1882)所發明,電池的陽極是鋅罐。陰極是一支碳棒(石墨棒),碳棒是惰性電極,只作為電子的通路,本身沒有直接參與化學反應。兩電極之間填滿了氯化銨(NH4Cl)為電解質、二氧化錳(MnO2)和氯化鋅(ZnCl2)的飽和溶液以及一些惰性漆料濕漿糊(圖1)。當電極被連接時,陽極的鋅即被氧化就失去電子(e–)。失去的電子便經由電線跑到陰極,使NH4Cl中解離出的NH4+離子還原成NH3,同時也形成氫氣。釋出的氫再被二氧化錳所氧化,而NH3則被利用形成錯合物Zn(NH3)2Cl2。
Zn(s) → Zn2+ (aq) + 2e–
陰電極上發生的還原作用:
2NH4+ (aq) + 2e– → 2NH3(aq)+H2(g) 2MnO2(s) + H2(g) → Mn2O3(s) + H2O(l)
鋅離子則與氨反應,生成錯合物:
Zn2+ (aq) + 2NH3(aq) + 2Cl–(aq) → Zn(NH3)2Cl2
電池內的整體反應:
2MnO2(s) + 2NH4Cl(aq) + Zn(s) → Zn(NH3)2Cl2 + Mn2O3(s) + H2O(l)
鋅碳電池的電壓為1.5 V,這種電池適用於只需少量電流的電器。此電池至少有兩個缺點,第一若電池放電太快便不能及時除去生成的氣體,令電壓減低,要暫停使用一會,電壓才能恢復到原來的水平;此外這種電池的壽命亦較短,這是因為除了鋅電極放電時會反應之外,電池在未使用時,酸性氯化銨也會與鋅電極發生作用。一段時間後鋅外殼會變薄,電池內的糊狀化學藥品便會泄出,因此在電池外常加上一層鋼製或膠製的外殼,防止與大氣作用,亦可防止糊狀化學藥品泄出。
生質燃料(Biofuel or Biomass)
生質燃料(Biofuel or Biomass)
台東專校化學科鍾玉峰退休老師/國立中山大學化學系張祖辛副教授責任編輯
不同於化石燃料(Fossil Fuel),生質燃料是取自剛死不久的有機體,包括植物、動物及其副產品。舉例來說:像是糞肥、庭園廢棄物及農作物殘骸都是生質燃料的來源。使用廢棄的生質(bio-waste)來產生能量,可減少化石燃料的消耗與溫室氣體的排放,並且減少污染與廢棄物的處理問題。最近歐盟報導強調生質能源可減少溫室效應,估計到2020年時,有相當於一千九百萬噸油的生質燃料可供使用。以碳循環(Carbon Cycle)的觀點來看,生質燃料與其他能源-如石油、煤、核能是不同的,它是一種再生能源。一般而言,生質燃料常用於交通工具的動力來源、室內取暖與日常烹飪等用途。
農業燃料(Agrofuel)是生質燃料的一種,有些農作物是特地為了用作生質燃料而栽種的。像在美國,主要有玉米、柳枝稷、大豆;歐洲有油菜籽、大麥、甜菜;巴西有甘蔗;中國有甜高梁、樹薯等。這些作物可區分為兩種:一種是含高糖量或高澱粉類的作物,如甘蔗、甜菜、甜高粱等,經過發酵(yeast fermentation)作用可產生乙醇(ethanol)。另一種是含高油量的作物,如油棕櫚、大豆、海藻等,這些植物油被加熱時,其黏度會降低,可直接在柴油引擎內燃燒,也可經化學處理,形成生物柴油(bio-diesel)。
廢棄電池(The Wasted Battery)
廢棄電池(The Wasted Battery)
台東專校化學科鍾玉峰退休老師/國立中山大學化學系張祖辛副教授責任編輯
現今電池的應用非常普遍,但它含有毒性的重金屬成分,例如鉛蓄電池中的鉛,鎳鎘電池中的鎳、鎘,水銀電池中的汞等,都具高毒性。如果廢棄電池沒做好適當的回收處理,將造成嚴重的土壤與水質污染,威脅到人類健康與生態環境。因此在享用電池的便利之際,能認清電池金屬成分的毒性及其可能造成的危害,做好防範與回收處理,有助於我們對環境維護,盡一分力量;並確保我們能擁有一個安全的生活空間。