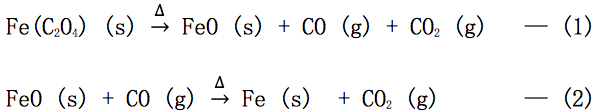3D 化學實驗:威猛的粉塵爆炸
3D 化學實驗:威猛的粉塵爆炸 (Powerful Dust Explosions)
國立彰化師範大學化學系 彭郁惠、顧展兆、楊水平
前言
2015 年 6 月八仙樂園派對粉塵爆炸事故是臺灣人心中永遠的痛,因使用玉米澱粉和食用色素所製成的色粉在舞台燈的高溫下,引發粉塵爆炸導致火災事故,造成重大的傷亡。為使民眾和學生深入瞭解粉塵爆炸的原理及概念,避免悲劇再度重演,本實驗使用家用產品奶精粉、麵粉、糖粉及黑胡椒粉,以瞬間擠壓方式,均勻地分散粉末在火焰上,發生旺盛的燃燒反應,產生粉塵爆炸的效果。