乙酸(Acetic Acid)
乙酸(Acetic Acid)
台北市立第一女子高級中學二年級許婷/台北市立第一女子高級中學化學科詹莉芬老師修改/國立台灣師範大學化學系葉名倉教授責任編輯
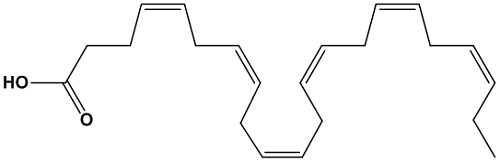
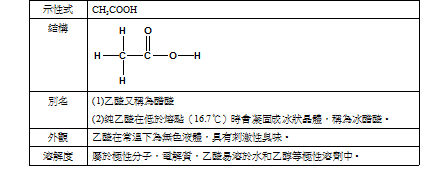
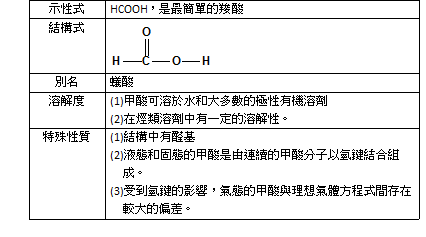
一、乙酸的基本性質
二、乙酸的製備/甲醇羰基化法
甲醇可與一氧化碳經由催化劑(金屬錯合物)催化反應生成乙酸:
CH3OH+CO→CH3COOH
整個反應分為三個步驟,以碘甲烷為中間體,催化劑主要參與第二個反應:
CH3OH+HI→CH3I+H2O
CH3I+CO→CH3COI
CH3COI+H2O→CH3COOH+HI
乙酸的合成歷史發展:
早在1925年開始,英國的就開始研究乙酸的合成反應,但由反應需高壓(200 atm)及抗腐蝕的容器,因此乙酸的製備一直無法商業化生產。
第一個商業化製造乙酸的過程,於1963年由德國化工公司BASF開發使用鈷催化劑。


 2HF(g)+CaSO4(s)
2HF(g)+CaSO4(s)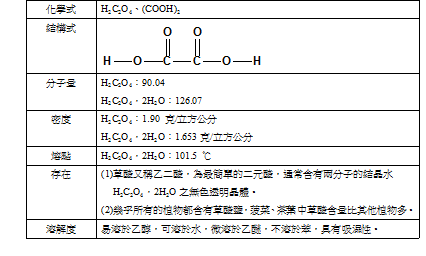
 CO+CO2+H2O
CO+CO2+H2O