酮(Ketone)
酮(Ketone)
台灣師範大學化學系葉名倉教授責任編輯
酮是一種具有顯著的氣味的有機化合物。它的結構是一個羰基兩端接上碳鏈,或是一個包含這個官能基的化合物皆被稱之為酮。酮的化學式通常被寫作:R1(CO)R2.。
連接在羰基上的兩個碳原子可以與羧酸、醛、酯、醘胺及其他含氧化合物作為區別;而羰基上的雙鍵可以和醇、醚有所區分。最簡單的酮是丙酮(acetone),IUPAC將它命名為2-丙酮(2-propanone)。
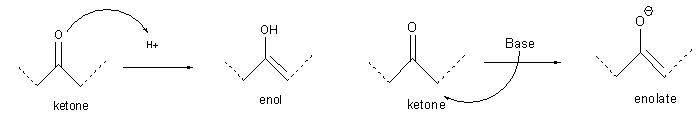
鍵結在羰基相鄰的碳原子稱之為α–碳(α–carbon),而附屬在α–碳上的氫原子稱之為α–氫(α–hydrogens)。在酸的催化下,酮容易與烯醇互變,稱之為酮-烯醇 互變反應(keto-enol tautomerism);如果和強鹼反應,會產生烯醇陰離子。雙酮(diketone)是一種有兩個羰基的化合物。
命名法
丙酮,最簡單的酮。
一般來說,酮類使用IUPAC命名原則將其來源的烷類詞尾的e改成one。但是對於一些常見的酮,如丙酮(acetone)和苯甲酮,亦稱二甲苯酮 (benzophenone)的俗名仍佔有主導地位, 雖然有一些普化原文書使用的名稱為propanone(丙酮) 。
oxo(酮基)是正式被IUPAC命名為酮的官能基。但是,其他字首仍被亦被使用在各式各樣的書籍和期刊。另外,對於一些常見的化學物質(主要在生化方面), keto 或oxy也用來描述酮的官能基。羰基上的氧易與過渡金屬產生配位。
物理性質
羰基具有極性,造成酮為極性分子。羰基與水分子之間由於產生氫鍵,造成引力變大,因此酮可溶解在水中。它是氫鍵的接受者,而不是氫鍵的提供者,彼此之間無法形成氫鍵。這使酮類比酒精或相近的分子量之羧酸更容易揮發。
酸度
酮的α-氫的酸性(pKa ≈ 20)遠大於烷類的酸性(pKa ≈ 50),這是由於分解後的烯醇陰離子有穩定的共振作用,酮與其他含羰基化合物的α-氫具有酸性是造成烯醇化反應的重要因素。
生物化學
丙酮,乙醯醋酸(acetoacetate)和β-羥基丁酸(β-hydroxybutyrate)是酮纇(或稱為酮體) 大多是從人或脊椎動物體內的碳水化合物、脂肪酸和胺基酸所產生。在一個睡眠的夜晚未進食之後,或是飢餓時,在血和尿裡,酮含量升高,低血糖將引起的除了胰島功能亢進外,還有各式各樣的先天性新陳代謝障礙,以及酮酸中毒 (通常由於糖尿病(Diabetes mellitus)所造成)。
雖然酮酸中毒為代謝機能減退(decompensated)或者未治療的第一類型糖尿病所獨有的特徵,但有些狀況下酮症或者甚至酮酸中毒也可能在第二類型糖尿病發生。
乙醯醋酸(acetoacetate)和β-羥基丁酸(β-hydroxybutyrate)在很多組織中為是重要的燃料,特別在禁食和飢餓期間。尤其是大腦,非常倚賴於酮體作為脂質合成的基質,和減少食物攝取的時間時所提供之能量。
國家衛生研究院的Richard Veech博士指出:酮就像”魔法”般增加新陳代謝的效率,同時減少自由基(正常的新陳代謝的有害副產品)的生產。他的報告顯示酮體可以治療像阿茲海默症和帕金森病精神上的疾病,並且可被心臟和大腦使用,作為25%以上的高效能源操作。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
