氧化劑 (Oxidizing Agents)
氧化劑 (Oxidizing Agents)
國立台灣大學化學系黃俊誠博士/國立台灣大學化學系陳藹然博士責任編輯
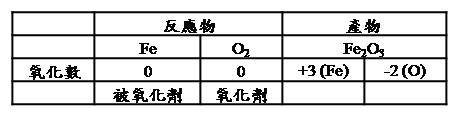
氧化是種常見的化學反應,譬如爆炸、化學合成、腐蝕反應都是氧化反應的種類之一;此外無論是金屬、非金屬與有機化合物等都可以進行氧化反應。例如,鐵氧化成氧化鐵(鐵銹,eq 1)、硫氧化成二氧化硫,有機烷類氧化就會形成二氧化碳和水(eq 2)等。4Fe + 3O2 → 2Fe2O3 (eq 1) CH4+ 2O2 → CO2 + 2H2O (eq 2) 氧化反應中最重要的兩個主角就是「氧化劑」和「被氧化劑」,eq 1和eq 2中的Fe和CH4是被氧化劑,而氧化劑就是佔空氣20%的氧氣(最常見的氧化劑)。
一般常見氧化劑都有含有很多氧,譬如臭氧(O3)、次氯酸與其鹽類化合物(漂白水(NaOCl)、氯酸鹽、亞氯酸鹽、過氯酸鹽以及類似的鹵素酸鹽化合物,還有硝酸、硝酸鉀(KNO3)、過錳酸鹽、過氧化氫(H2O2)及多倫試劑等。但是,有些氧化劑反而沒有氧元素的組成,例如,鹵素分子-氟、氯、溴、碘。 真正氧化劑的定義是:反應中若某一物質或元素的氧化數減少,則此反應物稱為氧化劑。而氧化劑的氧化數減少來自於「氧化劑」接受「被氧化劑」的電子,所以氧化劑又被稱為電子的接受者。(見表一)
此外氧化劑也被視為氧原子的移轉試劑,能夠將將本身氧原子轉移至其他物質身上,常見的多氧化物(polyoxides)如過錳酸根(MnO4−)、鉻酸根(CrO42−)、四氧化鋨(OsO4)和過氯酸根(ClO4−)。
3 SO32- (aq)+ 2 MnO4–(aq) + H2O(aq) →3 SO42-(aq) + 2 MnO2(s) + 2 OH–(aq) (eq 3)
部分氧化劑因為其可燃性而被定義為危險物質,本身易燃或是藉由產生大量氧氣而造成其他物質的燃燒,如重鉻酸鉀(K2Cr2O7)在酸性條件下與過氧化氫反應。
Cr2O72-(aq) + 8 H+ (aq) + 3 H2O2(aq) → 2 Cr3+(aq) + 3 O2(g) ↑+ 7 H2O(l) (eq 4)
而氧化劑在生活上的應用也很常見。如用於殺菌及其他醫療用途的過氧化氫。用於製造炸藥焰火、攝影藥劑和醫藥上的發光信號劑之強氧化劑-過氯酸鉀。臭氧可在短時間內將空氣中的浮游細菌殺死,並能中和、分解毒氣,去除惡臭。因此臭氧常用於淨化空氣、飲用水,殺菌,處理工業廢物和當作漂白劑。其他已於之前介紹過,在此不再詳細敘述。
參考資料:
1. Oxidizing agent. http://en.wikipedia.org/wiki/Oxidizing_agent
2. 氧化劑。http://baike.baidu.com/view/139716.htm
3.陳竹亭,高中化學上,泰宇出版社,第81頁,2008.




 前一篇文章
前一篇文章 下一篇文章
下一篇文章
