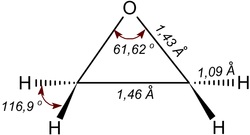
天然橡膠(natural rubber)
天然橡膠(natural rubber)
台北市立第一女子高級中學三年級李依柔/台北市立第一女子高級中學化學科詹莉芬老師修改/國立台灣師範大學化學系葉名倉教授責任編輯
簡介
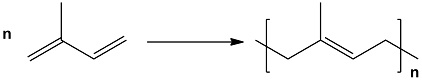
天然橡膠是一種有彈性的高分子聚合物,主要成分為聚異戊二烯,化學式為[C5H8-]n,其餘為蛋白質、脂肪酸、醣類等非橡膠物質。經過適當處理過的天然橡膠具有良好的彈性、絕緣性、可塑性等等特性,被廣泛運用在生活中的各種製品上,尤其是在汽車產業中的輪胎,天然橡膠更是不可或缺的一環。
主要單體成分—異戊二烯(Isoprene),IUPAC命名為2-甲基-1,3-丁二烯
異戊二烯是一種共軛二烯烴,化學式C5H8,在一般情況下本身是為不溶於水的無色液體,密度比水輕,但能與乙醇、乙醚、丙酮和苯等有機溶劑互溶。另外,它也容易和其他不飽和化合物共聚合,而自身也會互相聚合,若在特定條件的催化下聚合(譬如齊格勒-納塔催化劑-見註1),就會產生聚異戊二烯(Polyisoprene),也就是一般所知的天然橡膠。