酸雨(Acid Rain)
酸雨(Acid Rain)
國立台灣大學化學系學士生張育唐/國立台灣大學化學系陳藹然博士責任編輯
水是中性的,這是常識,但是如果你說那雨水(Rainwater)也應該是中性,就有待商榷。一般的雨水由於吸收了空氣中原本就存在的二氧化碳,二氧化碳溶於水中產生碳酸,碳酸解離出H+(式一),故正常的雨水亦會呈現弱酸性,其pH值大約落在5.6 ~ 5.7左右。
![]() (式一)
(式一)
但大自然除了二氧化碳之外,亦可能因為如火山爆發、閃電等因素釋放出一些酸性氣體,如二氧化硫和硫化氫,造成雨水pH值仍有機會下降到約5.0左右。當雨水的pH值低於5.0時,這種pH值呈現不正常酸性的雨稱為「酸雨(Acid rain)」。
隨著科技發達,人類大量使用能源進而在大氣中排放大量廢氣,除了大量的二氧化碳之外,最主要的致酸物質是硫氧化物(如SO2)、氮氧化物(NO、NO2)。這些氣體溶於水中,會產生較強的硝酸、硫酸等(式二):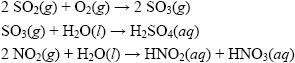 (式二)
(式二)
這些酸性物質讓雨水的pH值更加降低,甚至有降低到pH = 2.4的紀錄。 一般而言,SO2大多是由工廠、火力發電廠燃燒產生;除此之外,交通工具引擎的高溫亦可令空氣反應產生NO2。因此,酸雨較多發生在都會區,或者是工廠林立的區域。但由於季風的影響,實際發生酸雨的區域還會往下風處偏移。
酸雨會對生物的健康和生存造成極大的影響。在加拿大等北美地區,也曾經發生過因為大量酸雨使原本的淡水湖湖水酸化,導致魚類無法生存的事件。這是因為酸雨 造成湖水的pH值下降,當湖水的pH值小於6時,就有可能會影響到水中生物的繁殖與活動;而當湖水的pH值小於5時,那麼大多數的水中生物都會死亡。酸雨中的酸性物質對於人類的呼吸系統有嚴重的不良影響,可能造成如哮喘、過敏等症狀。此外,土壤中的金屬元素被酸雨溶解而流失,使植物無法獲得充足的礦物質,進而無法生長、枯萎死亡,同時一些有毒重金屬元素被酸雨溶解後被農作物或是動物的組織吸收,最終造成生物累積(Bioaccumulation),當人類將這被污染物吃下肚後,這些重金屬會引起人類神經系統等病變。
除了對生物的危害,酸雨也是破壞建築物、藝術品等的無形劊子手。酸雨在接觸大理石、石灰岩製的建築物、雕像時,會將溶解碳酸鈣(式三)形成了硫酸鈣,即俗稱的石膏。然而石膏的結構較為脆弱,不僅其對於水的溶解度較碳酸鈣高,也容易受到風化的影響,因而造成這些建築物的腐蝕與毀損;其多孔性的結構也容易吸附灰塵或是煤煙,使得這些建築物、雕像的表面變黑。而隨著雨的pH值越低,受到酸雨侵蝕的影響也就越為嚴重。![]() (式三)
(式三)
既然酸雨對於自然界造成諸多的危害,那麼控制酸雨就成為了國際上重要的課題。目前最主要的政策是限制工廠、製造業的廢氣排放,並且提倡大眾運輸工具、節約能源,避免太多自用交通工具造成的空氣汙染,並且再針對其他汙染源,如焚化爐、發電廠等進行管制。由於酸雨問題持續受到關注,目前全球二氧化硫的排放量,已經在逐年下降了。
參考資料:
1. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; pp. 176-177.
2. 台灣酸雨資訊網 http://acidrain.epa.gov.tw/


 前一篇文章
前一篇文章 下一篇文章
下一篇文章
