緩衝溶液
緩衝溶液(Buffered Solution)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
緩衝溶液(Buffered Solution),是指當溶液中加入酸或者是鹼時,會抗拒pH值的改變,使整體溶液pH值可以維持一個相對穩定的值。這對於一些化學反應的進行相當重 要;因為許多的化學反應是受到pH值的影響,在不同的pH值環境下進行反應會得到不同的產物,所以控制pH值在一定範圍內是非常重要的。
在生物系統當中,緩衝溶液則扮演了更重要的角色;因為生物體內的天然催化劑「酵素」,其主成份為蛋白質,蛋白質會因溫度和強酸鹼的 影響結構遭受破壞,進而降低甚至喪失催化活性,所以體內需要一個進行生化反應且能夠維持固定pH值的環境。在生物體中常見的緩衝溶液莫過於血液了。人類血液的pH值大約落在7.4左右,這是細胞可以存活的pH值,即使血液的pH只偏差了0.1,也會讓細胞死亡而有生命危險。
那些溶液可以提供pH緩衝的效果呢?「弱酸搭配弱酸鹽」或「弱鹼搭配弱鹼鹽」的溶液具有緩衝的效果。弱酸鹼可以具有緩衝的效果是因為其弱酸鹼的共軛酸鹼對(conjugate acid/base pair)之間存在的酸鹼平衡。例如:弱酸HA在水中之解離平衡式為
HA⇌H++A–
由於反應平衡的緣故,當三者任何一個濃度受到了影響,其他兩者的濃度都會互相透過平衡調整,以達到新的平衡。當我們在弱酸溶液中加入少量鹼的時候,此時[H+]的濃度明顯減少,反應趨向於往右邊進行,[H+]與[A–]上升,而[HA]下降。只要溶液中還有未解離的HA存在,即[HA]≠0,被加入的鹼中和掉的H+就能經由HA的解離得到補充,所以溶液內的[H+]不會出現明顯劇烈變化,溶液的pH值維持在狹窄的範圍內,達到緩衝pH的效果。
此外,多質子酸/鹼系統(Polyprotic acid/base)也是良好且常見的緩衝溶液系統,而且相較於單質子酸,其可以配合的pH值範圍較廣、選擇性較多。這是因為多質子酸可以在不同的pH值 範圍內,進行多個平衡反應。血液即是透過碳酸/碳酸氫根之共軛酸鹼對,維持其pH值的恆定。
磷酸為三質子酸,其解離方程式與酸解離常數(Acid dissociation constant, Ka)如下:
根據上式,磷酸鹽類各在酸性、中性、還是鹼性皆存在酸鹼平衡,如此一來,選用適當的磷酸鹽類可以配製出不同磷酸系統的緩衝溶液,適用於酸性、中性、或鹼性 環境。一個典型的例子是在生化實驗室常見的磷酸緩衝生理食鹽水(Phosphate buffered saline,PBS),利用磷酸氫鈉(Na2HPO4‧2H2O)與磷酸二氫鉀(KH2PO4)之共軛酸鹼對得到pH = 7.4的緩衝溶液,此生理食鹽水中還加入了氯化鉀、氯化鈉,這些鹽類雖無緩衝效果,用於調整溶液的離子濃度,使溶液的滲透壓等於細胞的滲透壓。
資料來源
1. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; p. 279-293.


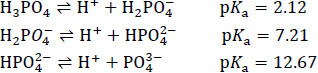
 前一篇文章
前一篇文章 下一篇文章
下一篇文章

http://www.unl.edu/cahoonlab/phosphate%20buffer.pdf
這個網站的
H2PO4-⇌H+ + HPO42-
pKa給的是6.86?
請問他是對的嗎?我需要這個網站的資料,因為我上網查了很多磷酸鹽緩衝溶液配製的網站只有查到這一個而已,但我不知道真實性
c54021115您好
責任編輯回應如下:
根據Chemical Principles: The Quest for Insight, H3PO4的PKa:2.0和6.59
管理員teresa 敬上