催化劑
催化劑 (Catalyst)
國立臺灣大學化學系學士生陳佳翰/國立臺灣大學化學系陳藹然博士責任編輯
催化劑(Catalyst)又稱觸媒,是一種以改變反應途徑的方式來影響反應活化能,藉以增快或減慢化學反應,但反應前後卻質量不變的物質。例如:某催化 劑A能降低反應活化能30 kJ/mol,則根據阿瑞尼亞士方程計算,在體溫37℃(310 K)下,反應速率約增快113540倍。
![]() 催化劑可分為三大類:
催化劑可分為三大類:
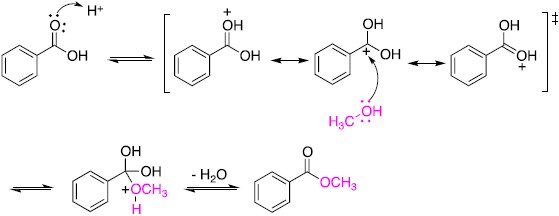
1. 均相觸媒或勻相觸媒(homogeneous catalyst)。此類催化劑與反應系統同一相態如液相或氣相,觸媒和反應物能均勻混合,因此在催化過程中並沒有受到觸媒與反應物接觸表面積大小的限 制。常見的酸催化酯化反應(acid-catalyzed esterification)即為在有機酸溶液中添加些許硫酸作為催化劑,使得羧酸基團(C(=O)(OH))上C=O的氧原子被質子(H+)活化形成活化錯合體(activated complex),醇的氧原子攻擊此活化錯合體中帶部份正電的碳原子,得到反應中間體(intermediate),最後脫去一分子水得到酯類(圖一)。