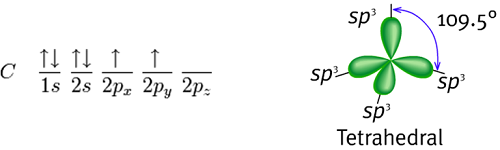混成軌域
混成軌域 (Hybridized Orbitals)
國立臺灣師範大學化學系邱緯航研究生/國立臺灣師範大學化學系葉名倉教授責任編輯
一、概論
在化學這門領域中,混成(hybridization)主要的概念是將多個原子軌域混合形成新的混成軌域(hybridized orbitals),它能用來定性地描述原子間鍵結的性質。除此之外,混成軌域在解釋分子的分子軌域形狀時非常有用,也通常與價層電子對互斥理論(valence shell electron-pair repulsion (VSEPR) theory)共同來解釋分子的形狀。
二、歷史沿革
混成理論是化學家萊納斯.鮑林(Linus Pauling)於1931年時提出的,當時他是為了要解釋甲烷(CH4)的簡單分子結構。本來這個概念主要是拿來解釋簡單的分子結構,不過這個方法被使用地越來越廣泛,以至於到今天已經成為一個有效而可以拿來合理化解釋各種有機化合物結構的方法。
軌域是一個能表現出電子在分子間行為的模型。就簡單的混成而言,它的估測主要是基於原子軌域,類似於氫原子所得到的結果,也是利用已知的薛丁格方程式(Schrodinger equation)精確計算出來的。若是對於重原子來說,像是碳、氮和氧,它們的原子軌域主要是利用2s及2p軌域,類似氫原子的激發態。混成軌域一般是假設為許多原子軌域的組合,以不同的比例疊加而成。混成軌域不一定要拿來描述分子,只不過對於那些利用碳、氮和氧(或少數含有硫、磷)所組成的分子來說,混成理論是可以讓分子結構的解釋更為簡單。
三、混成種類(不含d軌域的參與)
(1) sp3 混成(sp3 hybrids)
對於以正四面體的方式配位的碳原子來說,例如甲烷(methane,分子式CH4),它必須有四個軌域去鍵結四個氫原子。碳的基態電子組態是1s2 2s2 2px1 2py1:
以共價理論去預測,發現有兩個半填滿的p軌域,故碳可以與氫原子形成兩個共價鍵,即CH2。但是 CH2是活性非常高的分子,不可能單獨存在,也因此共價理論無法解釋甲烷的存在。除此之外,基態的電子軌域亦無法用於CH4的鍵結,但是當激發一個2s軌域的電子至2p軌域時,就能夠根據共價理論允許四個鍵結,也暗示著CH4四個鍵結因為有來自不同軌域的能階重疊而有不同的能量,不過有實驗駁斥了這個說法,也就是從CH4拔掉任何一個碳上的氫其實都是一樣容易的,所以也間接說明此四個鍵的能量其實是相等。