肆鍵與伍鍵(Quadruple Bond and Quintuple Bond)
肆鍵與伍鍵(Quadruple Bond and Quintuple Bond)
台北市立第一女子高級中學化學科周芳妃老師/國立台灣師範大學化學系葉名倉教授責任編輯
肆鍵的化合物
八氯二錸(III)化鉀是第一個被鑑定出具有肆鍵(Quadruple Bond)的化合物,由柯通教授(Frank Albert Cotton,1930~2007,美國)於1964年發表。柯通教授畢業於哈佛大學,在他31歲時(1961年),他成為麻省理工學院(MIT)教授,也是當時MIT大學最年輕的教授。柯通教授一生致力於過渡金屬的研究,一生發表論文達到驚人的1700篇。八氯二錸(III)化鉀(potassium octachlorodirhenate(III))的化學式為K2[Re2Cl8]•2H2O,雙錸之間的共價鍵為肆鍵。此肆鍵包含1個σ鍵、2個π鍵及1個δ鍵。八氯二錸(III) 錯離子(Re2Cl82-)的分子模型如下圖所示。
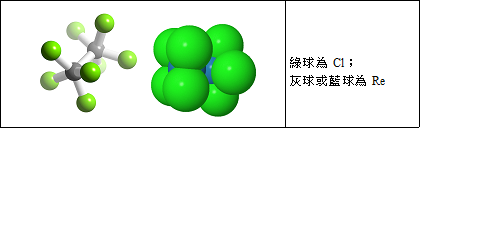
圖︰八氯二錸(III) 錯離子(Re2Cl82-)的分子模型
圖片來源︰http://www.3dchem.com/inorganicmolecule.asp?id=602#
目前的研究也發現早在1844年,具有肆鍵的雙鉻化合物就已經由法國科學家E. Peligot(Eugène-Melchior Péligot)合成出來,E. Peligot也是歷史上第一位從礦物中提取得到鈾化合物的科學家。E. Peligot合成的雙鉻化合物為醋酸二鉻(II) (Chromium(II) acetate),化學式為Cr2(O2CCH3)4(H2O)2。醋酸二鉻在合成後的一個世紀,後人才了解此為具有肆鍵的雙鉻化合物,分子模型如下圖所示。