理想氣體
標準狀況下理想氣體與真實氣體間的熵值差-以SO2為例(二)
標準狀況下理想氣體與真實氣體間的熵值差-以SO2為例(二)
The entropy difference between the ideal gas and real gas under standard condition – a case study in SO2 (II)
國立臺灣師範大學化學系兼任教師 邱智宏
連結:標準狀況下理想氣體與真實氣體間的熵值差-以SO2為例(一)
二、伯特洛方程式和臨界點
欲求出不同氣態物質在伯特洛方程式中的 $$a$$、$$b$$ 數值,則需對此方程式稍作瞭解。現以水蒸氣為例,以壓力對莫耳體積作圖,在 $$200^\circ C$$ 時,會出現一段水平線(NLJ),即體積減小壓力不變,此時開始有氣體凝結為液體,當溫度愈高時,水平的部分逐漸減短,到 $$374^\circ C$$ 時,水平線成為一點$$(C)$$,此點稱為臨界點( critical point ),此時液、氣間的界面消失,此點的溫度及壓力分別為臨界溫度$$(T_c)$$及臨界壓力$$(p_c)$$。
標準狀況下理想氣體與真實氣體間的熵值差-以SO2為例(一)
標準狀況下理想氣體與真實氣體間的熵值差-以SO2為例(一)
The entropy difference between the ideal gas and real gas under standard condition – a case study in SO2 (I)
國立臺灣師範大學化學系兼任教師 邱智宏
純物質的焓(enthalpy)、自由能(Gibbs free energy)及熵(entropy)是化學熱力學經常要使用到的數據,因此一般化學教科書均會將一些常見物質的相關數據,表列在附錄中,以供參考及使用。但是這些數據是如何求得的?卻鮮少被討論,尤其表列純物質的熵,若在標準狀態下為氣體,則其設定的情況為該氣體為理想氣體。
事實上理想氣體的標準莫耳相對熵$$(S^\circ_{m,id})$$和真實氣體的標準莫耳相對熵$$(S^\circ_{m,re})$$是不一樣的,它們之間的差距是多少?本文擬以 $$\mathrm{SO_2}$$ 為例,利用熱力學的公式,按部就班的推導它們之間的差異,除了讓學子利用所學,真正應用在解決問題上,也期盼學子能感受到在計算過程中數學所扮演的重要角色。
標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (二)
標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (二)
The enthalpy difference between the ideal gas and real gas under standard condition – a case study in C2H6 (II)
國立臺灣師範大學化學系兼任教師 邱智宏
連結:標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (一)
二、伯特洛方程式和臨界點
欲求出不同氣態物質在伯特洛方程式中的 $$a$$、$$b$$ 數值,則需對此方程式稍作瞭解。現以水蒸氣為例,以壓力對莫耳體積作圖,在 $$200^\circ C$$ 時,會出現一段水平線(NLJ),即體積減小壓力不變,此時開始有氣體凝結為液體,
標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (一)
標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (一)
The enthalpy difference between the ideal gas and real gas under standard condition – a case study in C2H6 (I)
國立臺灣師範大學化學系兼任教師 邱智宏
熱力學的主要內容除了三大定律及相關公式外,最常被討論到就是一些狀態函數(state function),而其中經常被使用到的數值,就是純物質的焓(enthalpy)、自由能(Gibbs free energy)及熵(entropy),因此一般化學教科書均會將一些常見物質的相關數據,表列在附錄中,以供參考及使用。
理想氣體和凡得瓦爾氣體的比較-以二氧化碳為例
理想氣體和凡得瓦爾氣體的比較-以二氧化碳為例
(Comparison of ideal gas and van der Waals gases – a case study in carbon dioxide)
國立臺灣師範大學化學系兼任教師 邱智宏
初學物理化學 (physical chemistry) 時,理想氣體 (perfect gas) 如影隨形,無時不在,隨時出現在各個不同的章節。由於理想氣體假設其氣體粒子不具有體積、粒子間没有吸引力、彼此間的碰撞為彈性碰撞,因此其 \(p \cdot V \cdot T\) 間的關係,可以簡潔的以 \(pV=nRT\) 加以描述。
然而真實氣體究竟佔有體積,彼此具有吸引力,碰撞時也非彈性碰撞,因此其許多特性和理想氣體不一樣,例如低溫高壓下,真實氣體大大偏離理想氣體、能被液化、有特殊的臨界點 (critical point)⋯ 等。歷來許多科學家總希望由簡潔的理想氣體方程式出發,企圖能找到一個足以說明真實氣體的方程式,其中凡得瓦爾方程式 (van der Waals equation) 就是一個很好的例子,在數學上雖然稍微複雜一些,但卻能解釋很多真實氣體的現象。
本文試著比較二種方程式的異同,並由其相異之處,解釋為何凡得瓦爾方程式更能接近真實氣體的理由。另外,以二氧化碳為例,觀察其相圖的變化情形,並說明凡得瓦爾方程式可信及不足之處。
均分定理
均分定理(Equipartition theorem)
國立臺灣大學物理系博士後研究員 羅雅琳
所謂均分定理是指對於古典系統來說,在當系統處在絕對溫度T之熱平衡下,每個自由度所貢獻的能量權重相同。舉例來說:若欲考慮理想氣體的平均動能,我們可透過馬克士威-波茲曼統計,來得知氣體分子運動時的方均根速率為[1]
\(v=\displaystyle\sqrt{v_x^2+v_y^2+v_z^2}=\sqrt{\frac{3k_BT}{m}}\cdots(1)\)
,其中 \(m\) 為粒子的質量,而 \(k_B=1.38\times 10^{-23}\)(單位:焦耳/絕對溫度)是為了紀念波茲曼在物理上的貢獻,而用其名字來命名的波茲曼常數。
可逆與不可逆過程、絕熱與等溫膨脹的差別(下)
可逆與不可逆過程、絕熱與等溫膨脹的差別(下)
國立臺灣師範大學化學系兼任教師邱智宏
二、絕熱與等溫可逆膨脹
理想氣體在等溫可逆膨脹的情況,已如上述說明,現將上篇圖一的裝置及操作方式稍做修改,即容器並非浸入等溫槽,而是處於絕熱狀態,亦即系統和外界間没能熱量的交換$$(\mathrm{d}q = 0)$$,其餘的操作則完全相同,為一可逆過程。當膨脹開始時,系統對外作功,因為是絕熱狀態無法對環境吸熱,因此將造成內能減少$$(\mathrm{d}U = \mathrm{d}q + \mathrm{d}w)$$,系統的溫度因而下降,不再像等溫可逆膨脹時一樣,溫度為定值。
由公式的推導可知,理想氣體在等溫時 $$p_TV_T=$$定值(下標 $$T$$、$$a$$ 分別代表等溫及絕熱過程),而在絕熱時,$$p_aV_a^\gamma=$$定值(請參考高瞻平台文章:定壓熱容量(Cp)和定容熱容量(Cv)的差別),其中 $$\gamma=C_p/C_V$$。
由於 $$\gamma$$ 大於 $$1$$,當二種過程從「相同」的起始點開始$$(p_TV_T=p_aV_a^\gamma=$$定值$$)$$,膨脹至相同體積時$$(V_T=V_a)$$,因為 $$V_a^\gamma>V_T$$,則絕熱系統的壓力下降比等溫系統多$$(p_T>p_a)$$,因此在圖二 $$pV$$ 相圖中,絕熱線下降的斜率比等溫線徙峭,而且如圖二所示,其結束點無法重合,必須再經過等容的加熱過程,絕熱膨脹方能再回到等溫膨脹過程的終點。
定壓熱容量(Cp)和定容熱容量(Cv)的差別(下)
定壓熱容量(Cp)和定容熱容量(Cv)的差別(下)
國立臺灣師範大學化學系兼任教師邱智宏
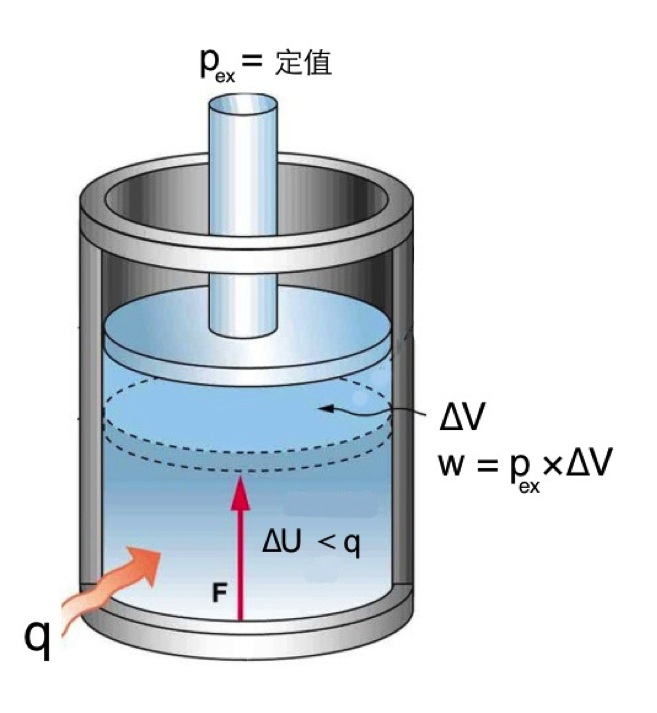
有了上篇 \(C_V\) 的測量基礎,為了更易於了解,我們先以氣體為例,若測定一定量氣體的 \(C_V\),其升高 \(1~K\) 所需的內能變化\((\Delta U)\),由於没有對外作功,其情況顯然和定壓下升高 \(1~K\),焓的變化量\((\Delta H)\)有所不同,如圖二所示:當系統在等壓情況下,吸收定量的熱時,除了系統的內能會增加,系統內的溫度因而上升,使容器內壓力加大向上膨脹,對外作功,直至內壓等於外壓\((p_{ex})\)時停止。此時系統對外做功\((w=p_{ex}\times \Delta V)\),因此系統吸收的總熱量\((q)\),有一部分要用來對外作功,所以系統增加的內能\((\Delta U)\)將小於 \(q\)。
據此,等量的物質,在定壓下系統上升 \(1~K\),所吸收的熱量\((q_p)\),要比在定容下上升 \(1~K\) 所需的熱量\((q_c)\)還要多,因此在氣態的物質中,\(C_p\) 恒大於 \(C_V\)。
理想氣體方程式
理想氣體方程式 (Ideal gas law)
臺中縣縣立中港高級中學物理科王尊信老師/國立彰化師範大學物理系洪連輝教授責任編輯
所謂理想氣體方程式是指理想氣體的壓力 \((P)\)、體積 \((V)\)、莫爾數 \((n)\) 與絕對溫度 \((T)\) 的關係滿足 \(PV=nRT\) 的簡單關係式,其中,\(R\) 為理想氣體常數 \(=0.082~\text{atm-L/mole-K}\) 或 \(8.31~\text{J/mole-K}\)。理想氣體方程式是根據波以爾定律(Boyle’s law)與查理定律(Charles’s law)結合而來。
理想氣體與真實氣體的差別,在於理想氣體不考慮氣體分子本身所佔的體積,只考慮氣體分子運動的體積。因為氣體本身所佔的體積並不考慮,所以理想氣體分子間的相互作用力也不考慮。相對地,對於真實氣體而言,氣體分子間相互作用力不可忽略,稱為凡德瓦力(Van der Waals force)。因為上述的種種性質,當真實氣體的凡德瓦力較小時,比較接近理想氣體,因此在高溫與低壓時,真實氣體接近理想氣體,比較接近理想氣體方程式的規範。
- 1
- 2