哈蒙德假說
哈蒙德假說 (Hammond Postulate)
國立臺灣師範大學碩士生二年級陳培杰
一、簡介
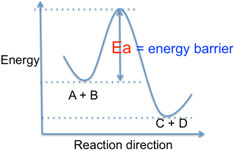
在發生化學反應時,由反應物轉變為產物的途中會經過一個過渡狀態,為反應過程中能量的最大值。所以過渡狀態變成產物、或者沿原途徑變回反應物不需要額外增加任何能量就可以達到,而且轉變過程會釋放出能量。哈蒙德假說(Hammond Postulate)則是利用過渡態與反應物和產物的能量關係來推測出該過渡態的狀態與反應物和產物的狀態何者較相似。
二、哈蒙德假說(Hammond Postulate)
在反應過程中,過渡狀態瞬間消失,沒有任何物理技術可以測得過渡狀態。
而化學反應是分子間發生化學鍵的斷裂或生成。因此科學家推論,過渡狀態應該是反應物的化學鍵發生了部分斷裂並且部分形成新的化學鍵擁有產物的特徵,為同時擁有部分反應物與部分產物的中間狀態。
哈蒙德假說:在化學反應中,過渡狀態最像能量跟他接近的穩定物質。