碳-14定年法
碳-14定年法(Carbon-14 Dating)
臺北市立第一女子高級中學 宋佳穎
原理
1905 年拉塞福 (Ernest Rutherford) 首先建議可以利用放射性礦物來決定岩石的年齡,第二年他在實驗室中定了一個含鈾礦物的年齡。同一年美國的化學家鮑爾伍也在耶魯大學做了同樣礦物定年的工作,但是他們所定出來的岩石年齡都嫌太老。
銥(Iridium)
臺北市立永春高級中學一年級廖秉彥/臺北市立永春高級中學化學科蔡曉信老師
銥是一種化學元素,18 世紀時科學家發現將鉑放入王水中,會產生可溶性鹽類,並會生成少量不可溶的殘留物。英國化學家特南特(Tennant)分析此殘留物,推斷可能有新的金屬元素存在。而後沃克朗(Vauquelin)把殘留物在酸鹼中浸洗,得到一種揮發性氧化物,他認為是新元素的氧化物。後來特南特又大量分析殘留物,而得到兩種新元素,即是鋨和銥兩種元素。
釤(Samarium)
臺北市立永春高級中學一年級陳忠霖/臺北市立永春高級中學化學科蔡曉信老師
釤是元素週期表中鑭系元素,原子序為 $$62$$,元素符號為 $$\mathrm{Sm}$$。中等硬度的銀白色金屬,在空氣中容易氧化。釤最常見的氧化數為 $$+3$$,但釤的二價化合物如氧化釤 $$\mathrm{(SmO)}$$、硫化釤 $$\mathrm{(SmS)}$$、硒化釤 $$\mathrm{(SmSe)}$$、碲化釤 $$\mathrm{(SmTe)}$$ 與二碘化釤 $$\mathrm{(SmI_2)}$$ 等亦很常見 ,其中二碘化釤在化學合成上是一種常見的還原劑。釤雖然歸類為稀土元素,但在地殼中是含量排名 $$40$$ 的元素比錫等金屬更常見。釤沒有顯著的生物學反應性,但具有些微毒性。
逸散 (Effusion)
國立臺灣大學 物理博士班 97級 鄭安良
當裝有氣體分子的容器外牆有一個微小的孔洞時,容器內的氣體分子會經由這個小洞慢慢的流出容器外。如果這個孔洞非常微小,在容器內氣體分子並不會明顯被改變其原本處於平衡的狀態,此時容器內氣體分子經由此微小孔洞流出到容器外的過程,我們就稱之為逸散(Effusion)。
然而,想要發生逸散的現象,容器的孔洞必須要多小呢?
我們知道平均自由徑 $$l$$ (Mean free path)的長度大約可以看成氣體分子之間自由的移動直到發生碰撞發生之前所走的距離,當氣體分子經過孔洞附近的區域,氣體分子溢出容器時沒有相互發生碰撞,也就是孔洞的直徑 $$D$$ 要小於氣體分子的平均自由徑的長度 $$l~(D<l)$$,這就是發生逸散時孔洞大小的條件。
同位素發現百年紀念
國立臺灣大學科學教育發展中心特約編譯郭冠廷

REFLECTION
Soddy in his lab at the University of Glasgow.
Credit: University of Glasgow Archive Services, GB0248 UP1/503/1
Frederick Soddy在一百年前的這個月發現:元素可以有幾種原子量。
1913年的12月4日,輻射化學家Frederick Soddy(弗雷德里克·索迪,1877年9月2日-1956年9月22日)提出「同位素」的概念。而Soddy也因此獲得1921年諾貝爾獎的殊榮。
一位早熟的少年
Soddy出生在1877年9月2日英國的Eastbourne,他是一位早熟的少年。在18個月大時,就面臨母親的去世,由信仰加爾文傳統(Calvinist tradition)[1]的堂妹扶養長大,也因此培養出索迪獨立於當代社會與宗教的獨立性思考模式。Soddy曾在Eastbourne學院、Aberystwyth學院Wales分院、Merton學院、Oxford大學就讀。而後於1898到1900之間,在Oxford大學進行獨立研究。
放射性蛻變的發現
1900年Soddy在McGill大學時,成為一名化學界的示威者。與英國物理學家Rutherford共同研究物質的放射性。而在當時,對放射性的瞭解可說是少之又少,而Soddy與Rutherford就已經意識到,放射性的存在,是肇因於元素的衰變。元素衰變時會釋放α-, β-, and γ-radiation。Soddy用化學方法來辨別出衰變的產物。並於1900到1902年之間的時8個月當中,Soddy和Rutherford共同出版了九篇歷史性的文章,文章當中提出了:原子分裂後可以產新的物質。而這正是古代煉金術師們的夢想,因此Soddy稱這個過程為煉金用語中的「蛻變(transmutation)」。
Rutherford和Soddy的放射性理論,解釋了蛻變的發生。他們是首位計算出放射性蛻變的過程中,會伴隨大量能量釋放過程的學者。可惜的是,Soddy因為被誤認為僅是Rutherford底下的年輕助手,而非工作伙伴。因而在這項發現當中,Rutherford獲得大部分的榮耀,而Soddy也因此與1908年的諾貝爾化學講擦身而過。
兩位學者共同提出放射線的存在,並從Uranium-92和Thorium-90出發。這兩個元素的最終產物都是Lead-82。因此兩位學者主張,Helium應該是Radium-88的衰變產物。
原子序 (atomic number)
國立臺灣大學物理系鍾豪
原子序 (atomic number) 是指原子核中質子的數量,因此又稱為質子數 (proton number),一般簡記為Z(Z是源於德文的Zahl,意思是「數字」),寫在元素符號的左下角。對於一顆電中性的原子而言,由於電子和質子數量相同,所以原子序大小也是電子的數量。
容易與原子序混淆的是質量數 (mass number) 和原子量 (atomic mass)。質量數是質子和中子數量的總合,一般簡記為A,寫在元素符號的右下角。因為電子質量極小(約是質子質量的1/1836),因此質量數可用來粗略表示該原子的質量。
碳-14定年法變得更準了
國立臺灣大學化學系博士生黃郁葳/國立臺灣大學科學教育發展中心博士陳藹然責任編輯
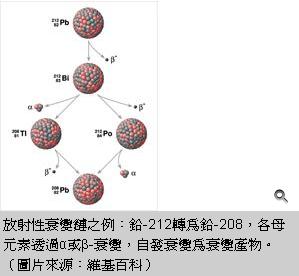 從氣候到考古學,有很多領域都利用碳的同位素,碳-14,的衰變情形為基礎,藉以推測物品的年代,稱為碳-14定年法。但是以碳-14的衰變量去決定物品的年代,需要考慮環境因素對碳-14衰變量造成的誤差。因此,如何得到正確的年代校正曲線,一直是科學家努力的目標。最近,有一批國際團隊裡面包含來自日本、德國、英國的研究學者發現,在日本福井縣著名的三方五湖中的水月湖(すいげつこ)的底部,累積許多藻類化石和落葉化石,測定這些已知年代藻類化石和落葉化石的碳-14含量,可得碳-14衰變量與年代的校正曲線,大幅提升碳-14定年法的準確性。
從氣候到考古學,有很多領域都利用碳的同位素,碳-14,的衰變情形為基礎,藉以推測物品的年代,稱為碳-14定年法。但是以碳-14的衰變量去決定物品的年代,需要考慮環境因素對碳-14衰變量造成的誤差。因此,如何得到正確的年代校正曲線,一直是科學家努力的目標。最近,有一批國際團隊裡面包含來自日本、德國、英國的研究學者發現,在日本福井縣著名的三方五湖中的水月湖(すいげつこ)的底部,累積許多藻類化石和落葉化石,測定這些已知年代藻類化石和落葉化石的碳-14含量,可得碳-14衰變量與年代的校正曲線,大幅提升碳-14定年法的準確性。
同位素於古環境研究上的應用(三)
臺北市立建國高級中學地球科學科葉昭松老師/國立台灣師範大學地球科學系劉德慶教授責任編輯
1953年Epstein等人根據實驗結果,首次發表方解石的碳酸鈣溫度轉換方程式,經過多位科學家研究並修正,於1991年Hays and Grossman綜合前人研究,並重新整理方解石同位素溫度方程式。
同位素於古環境研究上的應用(二)
臺北市立建國高級中學地球科學科葉昭松老師/國立台灣師範大學地球科學系劉德慶教授責任編輯
經由質譜儀分析而得的同位素數值要運用在古環境研究的解釋上,必須先瞭解自然界的同位素在反應過程中如何交換。雖然同位素有著相似化學性質與電子結構,但在物理性質上仍表現出質量數與比重的不同,因此在物理或化學反應過程中,會存在微量的變化,稱為「同位素分異作用(isotopic fractionation)」。
同位素於古環境研究上的應用(一)
臺北市立建國高級中學地球科學科葉昭松老師/國立台灣師範大學地球科學系劉德慶教授責任編輯
為了瞭解地球在漫長時代的氣候變遷歷史,除了分析文史記載外,科學家也發展了各種化學分析及統計方法,希望透過生物性或非生物性的地質材料,獲知古環境的訊息。在各種地質材料中,海洋生物的化石證據著實成為一個非常重要的紀錄來源,除了開放大洋可連續沉積的特性外,沉積在海床上的化石,也較陸地上的地層(無論是陸上沉積或抬升至地表的地層)而言,較不受到構造運動的影響,這些材料中又以具備碳酸鈣質殼體的生物化石最為重要。除了可使用肉眼或顯微鏡觀察組成分層外,若想進一步瞭解其中所含各種元素比例,就得藉助儀器分析,質譜儀在同位素分析化學中便是一個很重要的工具,利用外加磁場的作用,使得不同質荷比的帶電粒子,在飛行過程中,產生路徑偏轉差異,進而偵測其含量。