催化劑
金催化反應(Gold Catalyzed Reactions)(I)
金催化反應(Gold Catalyzed Reactions)(I)
國立臺灣師範大學化學系梁家榮博士班二年級
黃金是人類史上相當早就發現的金屬之一,西元前 2500 年前在埃及的雕刻上,就可以發現類似開採或冶煉的圖像。一般認為黃金是惰性的、極不易被氧化且不具催化活性的。由於黃金在地殼中的豐度約為 $$5\times 10^{-7}\%$$,屬於貴重金屬,故其價格也非常昂貴。尤其在近年黃金的市場價格大幅上漲,在過去幾千年的歷史中,僅僅用於做為貨幣或飾品的功用居多1。後來發現金具有良好的延展性且為抗腐蝕良導體的性質,才開始在電子產品上有更多應用。
黃金與大多數化學試劑不發生反應,但是可以溶於王水中,並可以再進一步製備而得到金(I)和金(III)試劑。近年來發現金(I)和金(III)離子在勻相催化( homogeneous catalysis)中對帶有炔基(alkyl group)的化合物具有催化活性之後,過去十幾年間世界各地的化學實驗室競相報導關於金催化的研究,掀起一波新的掏金熱潮。
金催化反應(Gold Catalyzed Reactions)(II)
金催化反應(Gold Catalyzed Reactions)(II)
國立臺灣師範大學化學系梁家榮博士班二年級
請參考連結:「金催化反應(Gold Catalyzed Reactions)(I)」
金離子相對於銀離子具有更多一層軌域可以提供配位(coordinate),以帶有炔基的反應物為例(如圖一)1,金催化的反應機制(mechanism)首先是先由富含有 $$\pi$$ 電子的炔基提供電子配位到金(I)離子上。而圖中銀試劑的功用是先與鹵素反應生成難溶鹽類的沈澱物氯化銀,此時催化劑屬於 $$sp$$ 混成軌域,結構為直線型的金(I)離子就能空出一個可配位的空間,成為缺電子的路易士酸能與炔基進行反應。
催化劑
催化劑 (Catalyst)
國立臺灣大學化學系學士生陳佳翰/國立臺灣大學化學系陳藹然博士責任編輯
催化劑(Catalyst)又稱觸媒,是一種以改變反應途徑的方式來影響反應活化能,藉以增快或減慢化學反應,但反應前後卻質量不變的物質。例如:某催化 劑A能降低反應活化能30 kJ/mol,則根據阿瑞尼亞士方程計算,在體溫37℃(310 K)下,反應速率約增快113540倍。
![]() 催化劑可分為三大類:
催化劑可分為三大類:
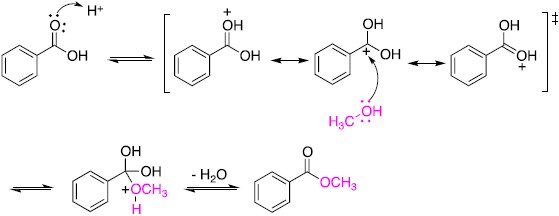
1. 均相觸媒或勻相觸媒(homogeneous catalyst)。此類催化劑與反應系統同一相態如液相或氣相,觸媒和反應物能均勻混合,因此在催化過程中並沒有受到觸媒與反應物接觸表面積大小的限 制。常見的酸催化酯化反應(acid-catalyzed esterification)即為在有機酸溶液中添加些許硫酸作為催化劑,使得羧酸基團(C(=O)(OH))上C=O的氧原子被質子(H+)活化形成活化錯合體(activated complex),醇的氧原子攻擊此活化錯合體中帶部份正電的碳原子,得到反應中間體(intermediate),最後脫去一分子水得到酯類(圖一)。
催化劑(catalyst)
催化劑(catalyst)
台灣師範大學化學系葉名倉教授責任編輯
在化學反應中,不是反應物也不是生成物,但是卻參與了反應的過程,並且可以改變化學反應速率的物質,稱為催化劑(catalyst)。工業上將催化劑又稱為觸媒,在生化反應中的催化劑則稱為酶(enzyme)。催化劑在反應完成後,本身質量既不增加,也不減少。催化劑可以多次使用於催化相同的反應,也就是說,催化劑具有很高的專一性。
催化反應的途徑都是會經過多重步驟,在某個步驟中催化劑又會被重新釋放出來。這些多重步驟也都伴隨生成一些中間產物(intermediate product),在某個步驟中中間產物又會被消耗而消失。例如下列一連串的反應步驟(1)~(4):
(1) A + C → AC
(2) B + AC → ABC
(3) ABC → CD
(4) CD → C + D
其中A和B是反應物,C是催化劑,D是產物,中間產物包含了AC、ABC以及CD。
反應步驟(1)~(4)最終的淨反應為: A + B → D 依據碰撞學說解釋反應速率的說法,催化劑因可藉著改變反應的路徑,而降低原反應的活化能,使反應物能量能夠超越活化能(低限能)的粒子數增加,造成有效碰撞分率更高,而使反應速率變快。