標準狀態的基準壓力改變時對熱力學數據的影響(一)
The effect on thermodynamic data when the standard pressure changed(I)
國立臺灣師範大學化學系兼任教師 邱智宏
定義標準狀態 (standard state) 時,首先必須訂定基準壓力,以往的壓力均訂為大家所熟悉的 $$1$$ 大氣壓力 $$(1~atm = 101,325~Pa)$$。但自 1982 年起,國際純化學與應用化學聯合會 (IUPAC) 將其改訂為 $$1~bar (10^5~Pa)$$。其所持的理由為帕 $$(Pa)$$ 為國際標準單位 (SI unit),目前已廣為各國科學界所使用;在處理平衡常數時,常使用到對數的關係式:$$\ln(p/p^0)$$,若 $$p^0=1~bar$$ 時,使用上甚為方便。
然而,在許多化學教科書上,仍沿用舊制,其拒抗的原因除了因循習慣以外,對於初學壓力的學子,一大氣壓相較於 $$1~bar$$ 是一個較為具體、不抽象的概念。可喜的是目前國內的高中化學教科書,自 95 課綱後,已經開始逐漸調整中1。
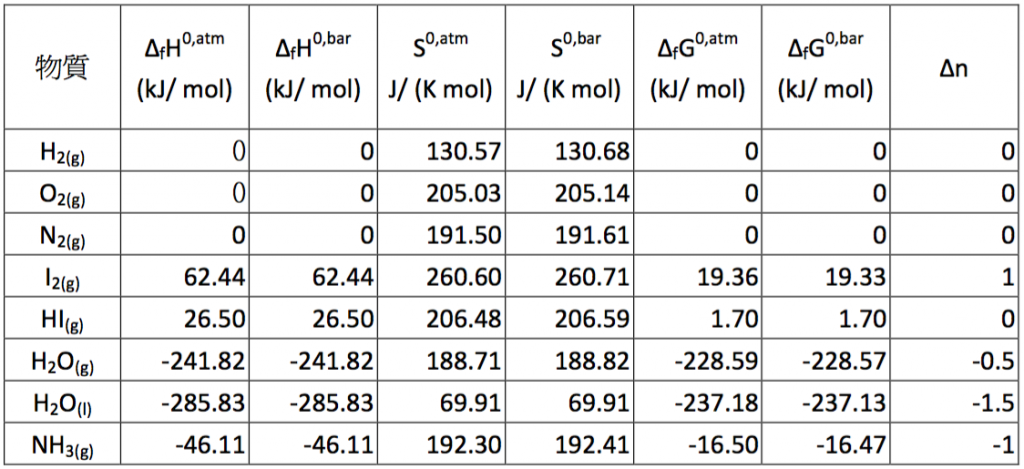
本文擬探討壓力由 $$1~atm$$ 改為 $$1~bar$$ 時,對於熱力學的數據 (thermodynamic data) 究竟有多大的影響,尤其是查表經常會使用到的 $$\Delta_f H^0$$、$$\Delta_f G^0$$、$$S^\circ$$ 及平衡常數 $$(K)$$ 等數值,並提供它們在二種不同壓力系統間的轉換方法。