胺(Amine)
胺(Amine)
台灣師範大學化學系葉名倉教授責任編輯
「胺」是有機化合物,也是一種以N為主要原子的官能基。在構造上,「胺」看似「氨」,而在這其中一或多個H會被有機取代基(如烷基、芳香基)。有一個有別於此種結構的例外就是 類型的化合物其C(O)指的就是羰基,因此他們就被稱為醯胺而不是胺。胺和醯胺具有不同的結構與性質,因此兩者在化學上的區分是非常重要的。有一點容易混淆的就是N-H基被N-M(M為金屬)基所取代的胺也稱作醯胺,因此(CH3)NLi就叫做lithhniu dimethyhmide。
胺在有機化學有如核心般,令人無法想像的重要!!。所有已知生物都要依靠氨基酸, 其中都包含胺基。
『介紹』
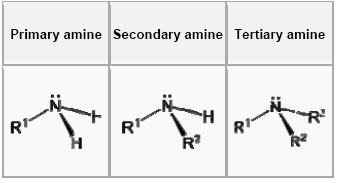
如下圖所示,當氨三個H中的一個被有機取代基所取代,那這就是一級胺了。而有2個有機取代機和H跟N鍵結的就是二級胺了!到底什麼才是三級胺呢?就是3個H都被有機取代基所取代的!那有沒有四級胺呢? 其實是可以使N接4個烷基的,其中的這些化合物都有一個為中心的N,所以加上一個陰離子是絕對必要的,他們就被稱為四級胺鹽。同樣的若是一個有機化合物帶著多個氨機就分別稱作二胺、三胺、四胺,以此類推。