化學實驗室實驗:透明肥皂的製作(Making Transparent Soap)〔III〕
國立彰化高級中學化學科林芬如老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
連結:透明肥皂的製作(Making Transparent Soap)〔II〕
教師手冊(Teacher’s Guide)
教學提示
● 上課時間:教師實驗解說:約20分鐘,學生實驗操作和記錄:約80分鐘。實驗結果和記錄:約10分鐘。問題討論或家庭作業:約30分鐘。由於本實驗有迴流加熱時間長達約60分鐘,教師可以調動實驗解說的時間在此段時間進行,以節省上課時間。
● 製作透明肥皂的代表油脂是棕櫚油與蓖麻油。蓖麻油能帶出香皂的透明感,而棕櫚油則能使香皂堅硬。製作透明皂基時不能有殘留的油脂,亦即不能減少鹼液。
● 為了製造透明度更佳的肥皂,蔗糖的選用方面,冰糖會比砂糖好,因為冰糖為無色的,砂糖有顏色。
● 製作完成的透明肥皂在放置兩個星期之後,會有縮水的現象,因為水及酒精蒸發了。透明肥皂的缺點是含有酒精,洗完後皮膚容易緊崩,感覺有點乾澀。透明肥皂遇到水馬上容易溶化,一下子就用完了。
● 若從模子拿出透明肥皂後會黏黏的或者是不夠透明,那麼可以把肥皂削成一小塊裝入大的玻璃容器裡,用電磁加熱攪拌器(或微波爐)加熱幾分鐘直到所有肥皂碎塊融化。如果有少許的肥皂碎塊留在混合液中,用玻棒(或湯匙)攪拌促使融化。也加入少許的酒精並攪拌促使融化。
● 手工香皂做完後成強鹼性請勿使用,待五週後pH值會降至約9,放置時間越久,pH值會慢慢降至8左右。pH 8為弱鹼性,可安心使用,一般市售香皂大多為弱鹼性。
藥品配製
● 本實驗不需要事先配製藥品,若想節省學生操作時間,則可以事先配製氫氧化鈉水溶液和蔗糖水溶液。
● 氫氧化鈉水溶液:先稱取11.34 g的氫氧化鈉和23.4 g的蒸餾水。再緩慢地加入氫氧化鈉固體到蒸餾水中,用玻棒攪拌至溶解。(每組用量)
● 蔗糖水溶液:稱取13.9 g的冰糖和12.05 g的蒸餾水,置入一個燒杯中,用玻棒攪拌直到完全溶解。(每組用量)
實驗紀錄樣本
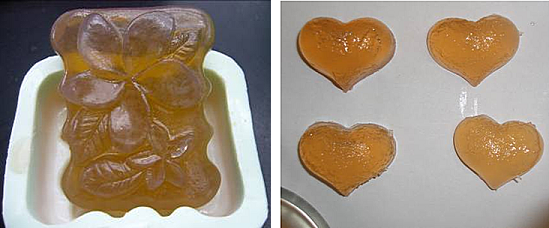
● 在自然風乾之後,從模型中取出透明肥皂成品,然後拍照並貼於此處。