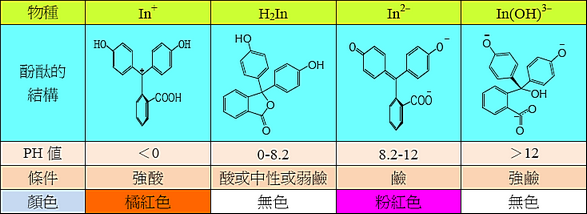
化學實驗室實驗:酚酞的合成及其四種形式的觀察(Synthesis of Phenolphthalein and Observation of Its Four Forms)〔II〕
國立彰化師範大學化學系學生方浩羽 / 國立彰化師範大學化學系楊水平副教授責任編輯
連結:酚酞的合成及其四種形式的觀察〔I〕
教師手冊(Teacher’s Guide)
進階原理
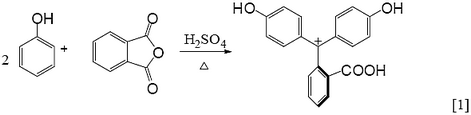
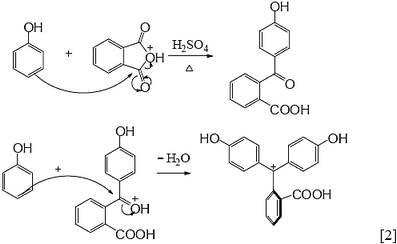
● 由苯酚和鄰苯二甲酸酐合成酚酞的反應機構分成兩階段:(1)在酸性條件下,鄰苯二甲酸酐的酸酐先進行質子化,然後正電荷轉移到酸酐上的碳。接著,苯酚的苯環富含電子去攻擊鄰苯二甲酸酐的酸酐上帶正電的碳,進行親電子芳香族取代反應(electrophilic aromatic substitution reaction),或說進行傅-克醯化反應(Friedel-Crafts acylation)。(2)同樣地,在酸性條件下,第一階段產物分子的酮基,先進行質子化,然後正電荷轉移到酮基上的碳。接著,第二分子的苯酚與其進行親電子芳香族取代反應,或說進行傅-克醯化反應。酚酞合成的反應機構簡單地如反應式[2]所示。
 教學提示
教學提示
● 上課時間:教師實驗解說:約20分鐘,學生合成酚酞:約30分鐘,學生觀察酚酞四種形式:約20分鐘。學生歸納所觀察到的現象和回答問題:約20分鐘。
● 在酚酞合成後,若酚酞四種形式的顏色觀察,改為直接以逐滴地加入極強鹼(高濃度)的氫氧化鈉溶液之方式進行,仍然可以觀察到與實驗步驟(先加入水和濃硫 酸,後加氫氧化鈉顆粒)有相同的顏色變化。然而,實際上會遭遇到一些困難。其一為無法配製極強鹼(高濃度)的氫氧化鈉溶液,其二為在測試溶液pH值時,由 於溶液過於濃稠而不易塗在pH試紙上,進而影響到pH值的判讀。
● 若在酚酞合成後不加入乙醇只加入水來溶解酚酞,則溶液會呈現混濁狀。在觀察顏色上會受到混濁狀況的干擾,而且在極鹼性條件下,會造成沉澱的現象。
● 實驗時,必須戴手套防止苯酚滲入皮膚而造成灼傷。如果學生不慎接觸到苯酚,應該先快速利用清水沖洗,然後塗抹凡士林。
● 全班可以共用一台加熱器和一個砂浴。如果沒有加熱器和砂浴,那麼也可以用沸水浴取代砂浴,只是反應時間需要20分鐘。沸水浴比砂浴更容易觀察酚酞合成是否完全,如圖六所示。

圖六 試管放入沸水浴中進行反應