可逆與不可逆過程、絕熱與等溫膨脹的差別(下)
可逆與不可逆過程、絕熱與等溫膨脹的差別(下)
國立臺灣師範大學化學系兼任教師邱智宏
二、絕熱與等溫可逆膨脹
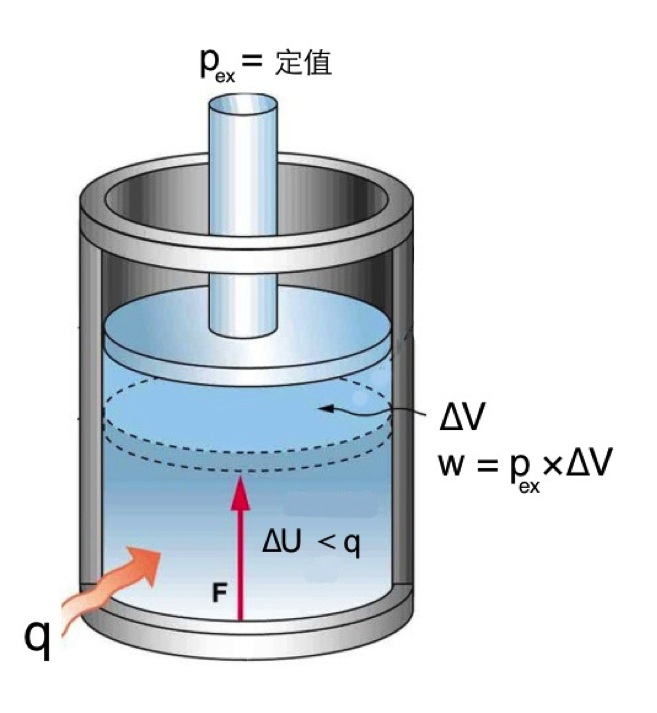
理想氣體在等溫可逆膨脹的情況,已如上述說明,現將上篇圖一的裝置及操作方式稍做修改,即容器並非浸入等溫槽,而是處於絕熱狀態,亦即系統和外界間没能熱量的交換$$(\mathrm{d}q = 0)$$,其餘的操作則完全相同,為一可逆過程。當膨脹開始時,系統對外作功,因為是絕熱狀態無法對環境吸熱,因此將造成內能減少$$(\mathrm{d}U = \mathrm{d}q + \mathrm{d}w)$$,系統的溫度因而下降,不再像等溫可逆膨脹時一樣,溫度為定值。
由公式的推導可知,理想氣體在等溫時 $$p_TV_T=$$定值(下標 $$T$$、$$a$$ 分別代表等溫及絕熱過程),而在絕熱時,$$p_aV_a^\gamma=$$定值(請參考高瞻平台文章:定壓熱容量(Cp)和定容熱容量(Cv)的差別),其中 $$\gamma=C_p/C_V$$。
由於 $$\gamma$$ 大於 $$1$$,當二種過程從「相同」的起始點開始$$(p_TV_T=p_aV_a^\gamma=$$定值$$)$$,膨脹至相同體積時$$(V_T=V_a)$$,因為 $$V_a^\gamma>V_T$$,則絕熱系統的壓力下降比等溫系統多$$(p_T>p_a)$$,因此在圖二 $$pV$$ 相圖中,絕熱線下降的斜率比等溫線徙峭,而且如圖二所示,其結束點無法重合,必須再經過等容的加熱過程,絕熱膨脹方能再回到等溫膨脹過程的終點。