【時事焦點】2015年諾貝爾化學獎 DNA修補 – 為生命提供化學的穩定
 編譯|臺大化學系教授 蔡蘊明
編譯|臺大化學系教授 蔡蘊明
從一個細胞到另外一個,從一個世代到另外一個,控制人類形體的基因資訊在我們的體內流傳了千百年,它不斷地受到來自於環境的攻擊,但讓人驚訝的仍能保持完整。Tomas Lindahl (林達爾)、Paul Modrich (莫瑞克)、與Aziz Sancar (桑賈爾) 獲得了2015年的諾貝爾化學獎,這是因為他們繪製並解釋了細胞如何修補它的DNA而保護了基因的訊息。
你到底是誰的依據,是在精子裡的23條染色體與卵子裡的23條染色體結合時所建立的,合起來它們形成了你體內最原始版本的基因體,亦即你的基因物質。所有需要用來創造你的基因資訊都存在於那個結合,如果有人將那些DNA的分子從這第一個細胞中抽出,並將它們排列起來,將會有兩公尺之長。
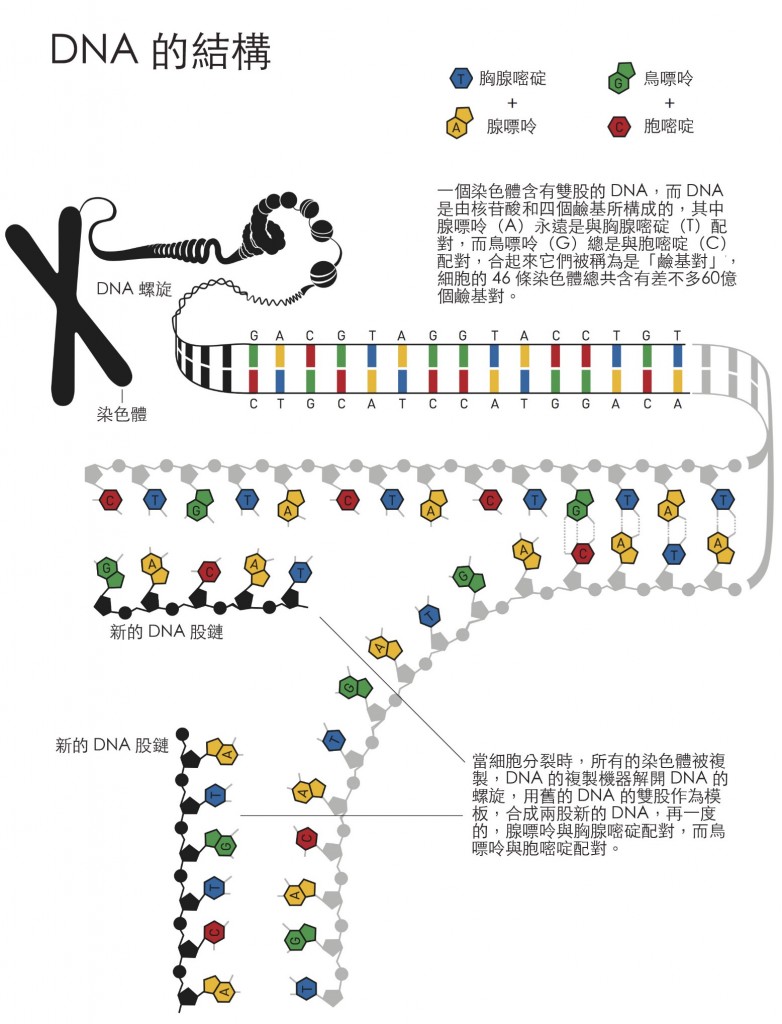
當受精卵接著分裂時,那些DNA的分子會被複製,所得到的子細胞也會得到一組完整的染色體,接著細胞再度分裂;二變四,四變八。在一個星期之後你擁有了128個細胞,每一個都擁有自己的一套基因物質,你的基因總長開始接近300公尺了。
現在 – 在許多許多億的細胞分裂之後 – 你的DNA可以一路伸展到太陽再繞回來,總共250圈,雖然你的基因物質被複製了那麼多次,那最近一次的拷貝仍然與原來在受精卵中製造出的原始版本幾乎完全相同,這就是生命分子所展示的偉大之處,因為從化學的角度來看,那應該是不可能的。所有的化學程序都很容易產生隨機的錯誤,此外,你的DNA每天都受到具有破壞性的輻射線以及高反應性分子的攻擊。事實上你早在發育成胚胎之前,就應該變成一堆混亂的化學體了。
●你的DNA受到一群蛋白質的監控
年復一年,我們的DNA仍令人驚訝的保持完整,那歸功於一組分子修補機制的執行者:一群監控基因的蛋白質,它們持續的校對基因體並修補任何出現的損壞。2015年的諾貝爾化學桂冠頒給了Tomas Lindahl (林達爾)、Paul Modrich (莫瑞克)、與Aziz Sancar (桑賈爾),因為他們在分子的層次弄清了這些基礎的過程,並對一些遺傳性疾病在分子層次的成因,以及癌症的發展和老化背後的機制提供了重要的知識。
林達爾、莫瑞克、與桑賈爾分別的描繪了幾種與人類相關的DNA修補程序,這個故事始於出生於與諾貝爾相同國家的林達爾。
●生命存在 – 因此DNA一定是可以修補的
「DNA到底真的有多穩定?」林達爾在1960年代的末期開始思考這個問題,在當時,化學的社群相信DNA的分子 – 所有生命的基石 – 是非常耐操的,根本不用擔心它們會發生甚麼事。演化的確需要突變,但是在每一個世代只會發生非常有限的次數,如果基因的訊息會很不穩定,將不會有任何多細胞生物體的存在。當他在美國普林斯頓大學進行博士後研究時,林達爾是在研究RNA分子,那是一個DNA的表親,但工作並沒有進行得很順利。在他的實驗中,需要將RNA加熱,但這總是導致該分子的快速分解。雖然當時已知RNA是比DNA更為敏感的,但是如果RNA受熱時會如此迅速的毀壞,那麼DNA真的會一輩子都很穩定嗎?這個問題開始駐留在他的心中。
在開始尋找這個問題的答案之前數年,他已經回到瑞典斯德哥爾摩的卡羅琳學院(Karolinska Institute),一些簡單的實驗證實他的懷疑是正確的:DNA會進行一個緩慢但可觀察到的衰變,林達爾估計每天會有上千個具潛在毀滅性的損傷出現於基因體中,這個頻率明顯的無法與人類在地球上存在的事實相存。他的結論是,一定存在著一個分子體系負責修補所有的DNA缺陷,基於這個想法,林達爾打開了進入一扇嶄新研究領域的大門。
●特殊的酵素移除DNA的損傷
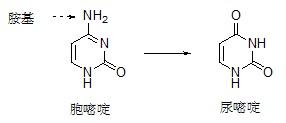
細菌的DNA與人類的DNA相仿,也是由許多核苷酸和腺嘌呤(A)、鳥嘌呤(G)、胞嘧啶(C)、與胸腺嘧碇(T)等鹼基組成,林達爾開始利用細菌的DNA來尋找修復用的酵素。一個DNA在化學上的弱點是胞嘧啶(C)很容易脫去一個胺基,這就導致基因訊息的改變。在DNA雙股螺旋中,胞嘧啶永遠是與鳥嘌呤(G)配對的,但是當胺基不見時,受破壞而剩下的部分傾向於和腺嘌呤(A)配對,因此如果讓這個缺陷存在,突變將會在下一次DNA複製時發生,林達爾體認到細胞一定會有對此問題的保護機制,進而能找到一個細菌的酵素,它能從DNA上移除受損的胞嘧啶所剩下的那部分。在1974年,他將研究的結果發表了。
●林達爾將鹼基切除式修復的謎底拼湊出來
這是35年成功研究的開始,林達爾發現並檢驗了許多在細胞工具盒中的DNA修復蛋白質。在1980年代的開始,一段感情將他帶到了英國,在那裏他接受了倫敦皇家癌症研究基金會的一個位置,而在1986年他成為新成立的克萊霍爾(Clare Hall)實驗室的主任,該實驗室後來因為其科學上的創造力而成名。一點一滴的,林達爾將「鹼基切除式修復」如何運作的分子圖像慢慢的拼湊了出來,在此步驟中一些類似他在1974年發現的一組酵素,稱為醣苷酶(glycosylases)者,是DNA修復過程中第一步的執行者。鹼基切除式修復也會發生在人體中,在1996年,林達爾成功的在體外重現了人體中修復的程序。
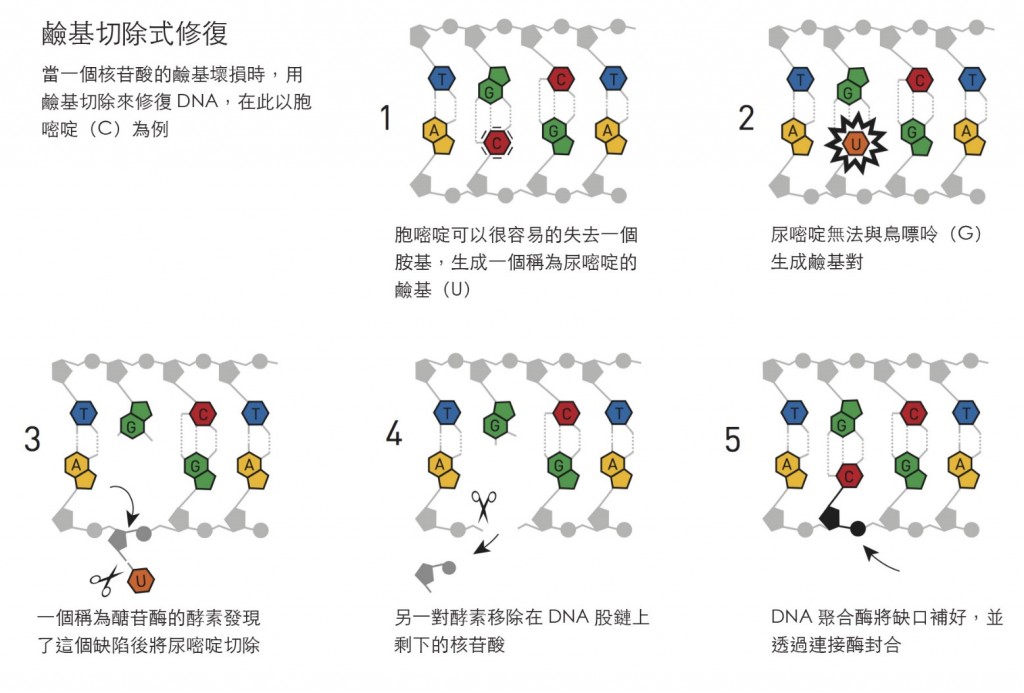
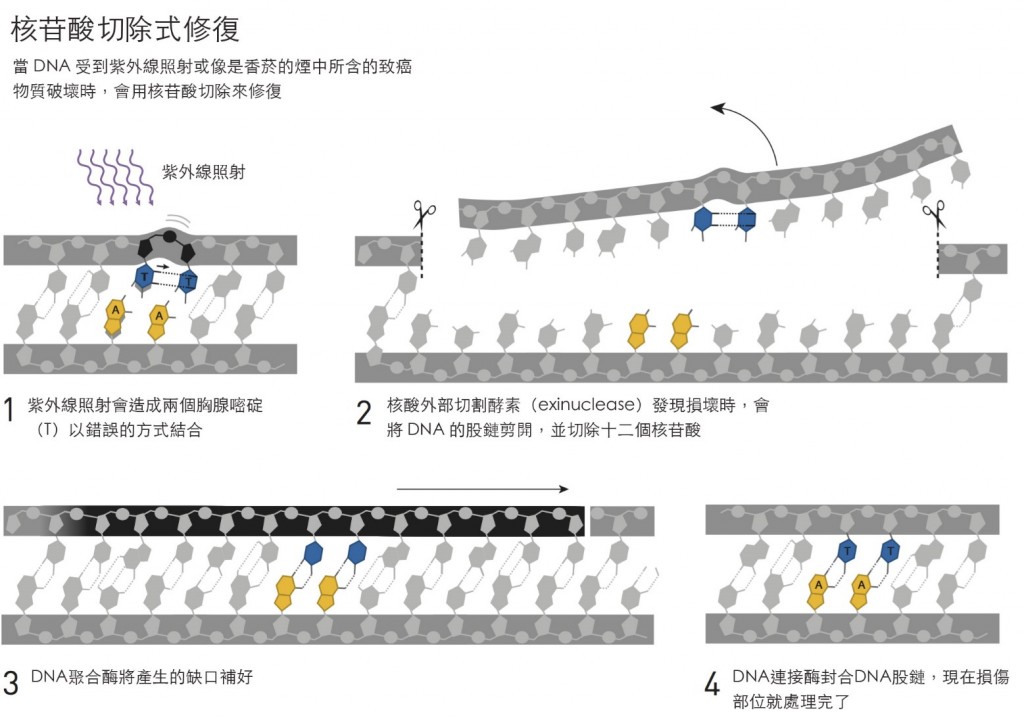
 對林達爾而言,決定性因素就是體認到即便是當其分子坐落於受到細胞保護的環境中,DNA仍不可避免的會進行改變。不過DNA會受到環境中如紫外線照射等的攻擊而受傷是早就知道的事,而大部分的細胞,修補紫外線造成的破壞所用的「核苷酸切除式修復」機制,則是由出生於土耳其薩武爾(Savur),但是在美國工作的桑賈爾所釐清的。
對林達爾而言,決定性因素就是體認到即便是當其分子坐落於受到細胞保護的環境中,DNA仍不可避免的會進行改變。不過DNA會受到環境中如紫外線照射等的攻擊而受傷是早就知道的事,而大部分的細胞,修補紫外線造成的破壞所用的「核苷酸切除式修復」機制,則是由出生於土耳其薩武爾(Savur),但是在美國工作的桑賈爾所釐清的。
●寧願靠生物化學生活而不做醫生
當桑賈爾還在伊斯坦堡修習醫學學位時,開始被生命分子的魅力所吸引,在畢業之後他在土耳其鄉下行醫,並工作了數年,但是在1973年,他決定開始研究生物化學,有個現象特別地激發了他的興趣:當細菌暴露於致死劑量的紫外線後,如果接著將它們用可見波段的藍光照射,會突然的復原。桑賈爾對這個幾近於奇蹟的效應非常的好奇;在化學上,那是如何運作的?
一位美國科學家Claud Rupert (路伯特)研究過這個現象,因此桑賈爾加入了路伯特位於美國達拉斯,德州大學的實驗室。在1976年,運用當時仍然生澀的分子生物工具,桑賈爾成功的選殖(cloning)了修補被紫外線破壞的DNA所用的「光分解酵素」(photolyase)之基因,這份工作成為他的博士論文,但是這份研究並未給人深刻的印象;他申請了三份博士後研究的工作,但都被打了回票,因此對於光分解酵素的研究必須放回架上。為了繼續研究DNA修補,桑賈爾在耶魯大學藥學院找到了一個實驗室技術員的工作,那是一個在該領域中持領先地位的研究機構,在這裡開始了最終導致他獲得諾貝爾化學獎的工作。
●桑賈爾 – 研究細胞如何修補紫外線造成的破壞
當時已經清楚的知道細菌具有兩套系統來修補紫外線的破壞:除了倚賴光線的光分解酵素,另一個在暗室中運作的系統也被發現。桑賈爾在耶魯大學的新工作同仁們自1960年代中期就開始研究這個暗室的系統,用了三個對紫外線敏感的細菌菌株,它們攜帶三種不同的基因突變:uvrA,uvrB,與uvrC。
如同他先前對光分解酵素的研究,桑賈爾開始探究這個暗室系統的分子運作機構。在幾年之內他想辦法找到、分離、並鑑定了這些被uvrA,uvrB,與uvrC所編碼的酵素。在一系列突破性的體外實驗中,他展示了這些酵素能找出一個被紫外線破壞的位置,然後在DNA股鏈上製造兩個切口,分別在受損位置的兩端,接著,一個包含受損位置的12-13個核苷酸片段被移除。
●人類與細菌運用類似的紫外線損害修補機制
桑賈爾這種從這個修補過程的分子細節中取得知識的能力,改變了這整個研究領域。他於1983年發表了這些發現,這個成就讓他獲得位於教堂山(Chapel Hill),北卡羅萊納州立大學生物化學系的副教授之職。在那裏,以同樣的精準度,他繪製出核苷酸切除式修復的下一階段。與其他包括林達爾在內的研究工作者平行的,桑賈爾研究了人體中的核苷酸切除式修復。將人體DNA中受紫外線破壞的部份切除的分子運作機構,比相對的細菌更為複雜,但是從化學的角度來看,核苷酸切除式修復在所有生物中的運作都很相似。
那麼,桑賈爾最初有興趣的光分解酵素又如何了呢?是的,他終究回到了這個酵素,揭開了讓細菌起死回生背後的機制。此外,他幫忙證實了有一個人體中對等於光分解酵素的化合物,幫助我們設定晝夜節律。
該是讓我們來看看莫瑞克的工作的時候了,他也是從一個與修補機制有關的模糊想法開始的,從而以精采的分子細節雕繪出其輪廓。
●學習「DNA這個東西」得到回報
莫瑞克成長於美國新墨西哥州北部的一個小鎮,那裏廣闊的景觀觸動了他對大自然的興趣。但是有一天,他的父親,一位生物老師,對他說「你應該學習這個叫做DNA的東西」。那是在1963年,正是華特生與克里克因為發現DNA的結構而得到諾貝爾獎之後的那一年。
幾年之後,那個「DNA的東西」真的成為莫瑞克生活中的核心。他早期的研究生涯,包括史丹福大學的博士生,哈佛大學的博士後研究員,以及擔任杜克大學(Duke University)的助理教授,研究了一系列會影響DNA的酵素:DNA連接酶(ligase),DNA聚合酶(polymerase),以及Eco RI這個限制酶(restriction enzyme)。接著在接近1970年代末期,當他轉移注意力到Dam methylase (甲基化酶)這個酵素時,偶然發現了另一塊「DNA的東西」,那最後佔據了他科學生涯的一大部分。
●兩股研究的交織
Dam甲基化酶會將甲基偶合到DNA上,莫瑞克展示了這些甲基可以作為信號站,幫助一個特定的限制酶在正確的位置切割DNA的股鏈。不過在幾年之前,在哈佛大學的一位分子生物學家,Matthew Meselson(麥瑟森),提出了DNA上甲基的另一種訊息功能。
運用一些近乎藝術的分子生物技巧,麥瑟森建立了一個噬菌體(bacterial virus),具有DNA上的數個誤配的鹼基對,例如,A可能對到C而不是T。當他讓這些噬菌體感染細菌時,細菌修正了那些誤配。沒人知道為何此細菌會發展出這個功能,但是在1976年,麥瑟森做了一些推測,其中之一是它可能為一種修補機制,更正了那些在DNA複製時偶而發生的誤配。如果這是正確的,麥瑟森繼續的推測,或許這些DNA上的甲基能幫助這個細菌辨識哪一股是在修正時被用來作為模板的。此時新的那股DNA,亦即錯誤的複製品,尚未被甲基化,或許這是為何它能被辨識而修正。
此處 – 有關DNA的甲基化 – 莫瑞克與麥瑟森的研究路徑交會了。一同合作,他們創造了一個DNA上具有數個誤配的噬菌體,這一次,莫瑞克的Dam甲基化酶也用來在DNA其中的一股上加入一些甲基。當這些噬菌體感染了細菌後,這個細菌始終如一的只修正沒被甲基化的那股DNA。莫瑞克與麥瑟森的結論是,DNA「誤配修補」是一個在DNA複製時,產生誤配的天然修補程序,由於瑕疵股仍在未被甲基化的狀態而被認出。
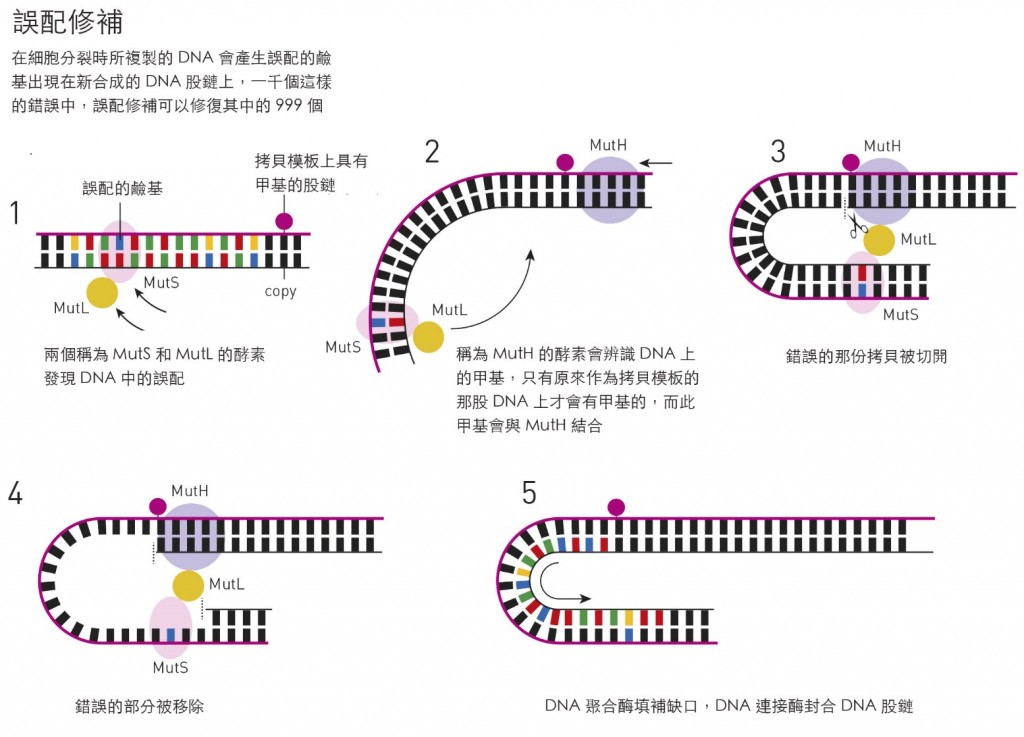
●莫瑞克 – 闡明DNA誤配修補
對莫瑞克而言,這個發現啟動了一個十年之久的系統性研究,對誤配修補程序中一個接著一個的的酵素進行選殖和基因定位。在1980年代的末期,他已經能在生物體外重現這個複雜的分子修補機制,並對之進行非常仔細的研究,這份工作於1989年發表。
莫瑞克正如林達爾和桑賈爾一般,也研究了人類版本的系統。現今我們知道當人類基因體在複製時所產生的錯誤中,每千個只有一個沒被修正。不過,在人類的誤配修補中,我們仍然尚未確知原始的那一股是如何被認出的。與細菌相較,DNA的甲基化在我們的基因體中還具有其它的功能,因此一定還有其它的方式在管控哪一股會得到修正 – 到底是甚麼在控管仍待釐清。
●修補系統的缺陷導致癌症
除了鹼基切除式修復,核苷酸切除式修復,以及誤配修補,還有好幾個其它的機制在維護我們的DNA。它們每天要修正上千次因為太陽、香菸的煙霧、或其它具基因毒性的物質對DNA造成的的損傷;它們持續的對抗自發性變異的DNA,而對每一次的細胞分裂,誤配修補修復數千個誤配。若無這些修補機制,我們的基因體將會瓦解。即使只有一個零件失靈,基因的資訊會迅速的改變而癌症的風險就會增高。核苷酸切除式修復的先天性損壞,會導致著色性乾皮病(xeroderma pigmentosum);得到這種疾病的人對紫外線的照射極度敏感,並會在暴露於陽光之後發生皮膚癌。DNA誤配修補的缺陷,會增加發生遺傳性大腸癌的風險。
實際上,在許多種癌中,一個或多個的這些修復系統是被完全或部份的關閉了,使得癌細胞的DNA不穩定,這是癌細胞為何經常突變而且對化療會產生抗藥性的一個原因。在同時,這些生病的細胞會更倚賴仍在運作的修復系統;沒有了這些系統,它們的DNA會變得過度損傷而細胞將會死亡。研究人員正企圖利用這個弱點來研發新的治癌藥物,抑制一個殘存的修復系統讓它們能減緩或完全停止癌的生長;一個抑制癌細胞修復系統的藥物的例子是olaparib (奥拉帕尼)。
總結,由2015年諾貝爾化學獎得主們進行的基礎研究,不僅僅加深了我們如何運作的知識,也能導致挽救生命的醫療發展。或者用莫瑞克的話語:「這是為何好奇心驅使的研究是如此的重要,你永遠不知道它將會走向何方…一點運氣也有些幫助。」
--蔡蘊明於2015年十月八日譯
本文譯自諾貝爾化學獎委員會公佈給大眾的新聞稿,原文可自以下官方網站取得:
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2015/popular.html
若有興趣閱讀進階的資料,請由下列網址取得:
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2015/advanced.html
*特別感謝現於美國德州農工大學攻讀博士的曹一允(我2008年的專題生)熱血相挺,幫我將圖片中文化兼校稿,正在國外進行人工DNA合成研究的一允宣稱今年的化學獎令他百感交集;另外感謝現於本系李弘文教授實驗室,攻讀碩士學位的林宇軒幫我校稿;還要感謝蔡明軒幫忙將此文放上台大化學系的網頁。附帶一提的是台大化學系的李弘文教授告訴我,莫瑞克在2013年來過台灣,並訪問過台大化學系;桑賈爾則在2012和2014年兩度來台,並造訪過台大化學系。林宇軒也告訴我:他們倆位來化學系的時候,和他們一起討論實驗的經驗真的很特別,提供許多深刻的見解和建議,會有醍醐灌頂、豁然開朗的感覺。幸哉!宇軒。
--本文載自http://www.ch.ntu.edu.tw/nobel/2015.html 感謝蔡老師提供。

倒數第二段的說法邏輯上是很怪的,
「實際上,在許多種癌中,一個或多個的這些修復系統是被完全或部份的關閉了,使得癌細胞的DNA不穩定,這是癌細胞為何經常突變而且對化療會產生抗藥性的一個原因。」
「研究人員正企圖利用這個弱點來研發新的治癌藥物,抑制一個殘存的修復系統讓它們能減緩或完全停止癌的生長;一個抑制癌細胞修復系統的藥物的例子是olaparib (奥拉帕尼)。」
如果癌細胞修復系統是被完全或部份的關閉了,基本上不需花心思去抑制DNA修復機制,
比較貼切的用法是:在癌細胞,修復系統是不只是被關閉,有可能被異常開啟,因此才能合理對化療產生抗藥性的情況。
因此在核苷酸切除式修復(NER)中,有多篇paper提過ERCC1就是一個臨床上很重要容易過度表現造成抗藥性的基因,
同時鹼基切除式修復(BER)也有如XRCC1, APE1等基因都是在癌症高度表現的例子。
DNA修復機制是雙面刃,過強過弱都可能導致基因體不穩定,在細胞內如何取得平衡,有賴更多蛋白質的參與。